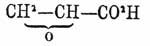
| [ начало ] | [ Г ] |
Глицериновая кислота
СН 2 (НО).СН(НО).СО 2 Н — есть трехатомно-одноосновная спиртокислота. Строение ее установлено синтезом (Franc), исходя из монохлоральдегида CH 2 Cl.СОН, который с синильной кислотой дает нитрил ß- хлоромолочной кислоты
СН 2 Cl.COH + HCN = СH 2 Cl.СH(НО).CN + 2Н 2 О + НCl = СН 2 Сl.СН(НО).СО 2 + NH4Cl,
а последняя с окисью серебра дает Г. кислоту
СН 2 Cl.СН(НО).CO 2H + AgHO = СН 2 НО.СH(НО).CO 2H + AgCl.
Она образуется также при обработке окисью серебра кислот α-хлорэтиленмолочной СH 2 (НО).СНCl.CO 2 H (Меликов) и αβ-дибромпропионовой CH 2 Br.CHBr.СО 2 Н (Beckurts, Otto). Получается Г. кислота обыкновенно медленным окислением глицерина азотной кислотой, для чего разведенный водой (1 часть) глицерин (1 часть) помещают слоем на дымящую азотную кисл. (1 часть) в высоком стеклянном цилиндре и оставляют стоять в течение нескольких дней на холоду, по прошествии которых раствор выпаривают до малого объема, разводят сильно водой, насыщают углекислым свинцом, образовавшуюся свинцовую соль Г. кислоты извлекают кипящей водой, разлагают сернистым водородом и осторожно выпаривают полученный водный раствор кислоты (Соколов, 1853, Debus 1858, Mulder). Весьма чистой и бесцветной она получается из разведенного водой глицерина окислением окисью ртути в присутствии избытка едкого барита и разложением полученного раствора баритовой соли серной кислотой (B ö rnstein, 1885). Г. кислота представляет густую сиропообразную жидкость, растворимую в воде и спирте и нерастворимую в эфире; оптически она недеятельна, но под влиянием плесени (Peniciliumglaucum) образует левовращающую модификацию (Левкович). Взятая в виде кальциевой соли, она бродит под влиянием особого грибка (Spaltpilz), образуя или уксусную кислоту с примесью янтарной, либо муравьиную с примесью уксусной, и в обоих случаях некоторое количество спирта (Fitz). При действии йодистого фосфора PJ 3 или йодистого водорода переходит, отчасти восстановляясь, в ß- йодопропионовую кислоту (Бейльштейн, V. Meyer):
СН 2 (НО).СН(НО).CO 2H + 3HJ = CH2 J.СН 2.CO2 H + 2Н 2O + J2,
с пятихлористым фосфором, РCl 5, дает хлорангидрид αβ-хлоропропионовой кислоты CH 2 Cl.CHCl.COCl, a с НCl в запаянной трубке — αβ-хлоропропионовую кислоту C H2 Cl.CHCl.COH. При нагревании со спиртом образует сложный эфир СН 2 (НО).СН(НО)СО 2 (С 2H5) (темп. кип. 230 — 240°), который, имея в своем составе 2 спиртовых водных остатка, с азотной к., взятой в смеси с серной, дает двухазотный сложный эфир CH 2(NO3).CH(NO3).СО 2 (С 2H6), в виде тяжелого, не растворимого в воде масла (Henry). При продолжительном хранении Г. кислота теряет частицу воды, переходя в кристаллический ангидрид C 3H4O3, не растворимый в спирте и в эфире, трудно растворимый в воде и кристаллизующийся из нее в форме длинных игл (Соколов). Другой ангидрид того же состава получается в виде тягучей массы при 10-часовом нагревании Г. кислоты до 105° (Debus). Третий ангидрид, глицидная кислота
полученный при действии КНО из обеих хлоромолочных кислот, представляет жидкость, легко растворимую в воде, спирте и эфире (Меликов, Erlenmeyer). Все эти ангидриды при кипячении с основаниями легко переходят обратно в Г. кислоту. Соли Г. кислоты более или менее растворимы в воде, особенно в горячей, и большей частью нерастворимы в спирте. Известковая соль Ca(C 3H5O4)2 + 2Н 2 O (блестящие листочки), бариевая Ba(C 3H5O4)2, свинцовая Pb(C 3H5O4)2 (твердые кристаллические корочки), серебряная AgC 3H5O4 (микроск. призмы).
П. Рубцов.
|
Page was updated:Tuesday, 11-Sep-2012 18:15:04 MSK |