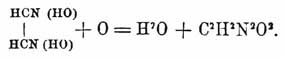
| [ начало ] | [ Г ] |
Гремучие соли
— суть взрывчатые металлические производные так называемой гремучей кислоты, состав которой отвечает формуле C2H2N2O2. То же название, кроме того, придается некоторым взрывчатым аммиачнометаллическим соединениям, напр., при взаимодействии окислов серебра Ag2O и золота Au2O3 с крепким раствором аммиака NH3 образуются осадки Ag2OnNH3 (где величина n с достоверностью не известна) и Аu 2O3·4NH3, которые вследствие своей взрывчатости при трении, ударе и нагревании известны под именем гремучего серебра и гремучего золота. Но особенный интерес представляют собственно солеобразные вещества первого рода, т. е. отвечающие гремучей кислоте, которые поэтому правильнее назвать (подобно солям всех кислот) гремучекислыми солями. Значение их в практике определяется применением ртутной соли в ударных капсюлях, служащих для воспламенения пороховых зарядов в огнестрельных орудиях, а также в запалах, производящих особый вид разложения взрывчатых веществ, называемый детонацией. С другой стороны, свойства и превращения этих солей настолько своеобразны в теоретическом отношении, что вопрос об их конституции не переставал занимать химиков в течение почти всего настоящего столетия и до настоящего времени. Рассмотрение именно: 1) способов приготовления собственно гремучекислых солей, 2) их химической конституции, 3) их взрывчатых свойств, и составляет предмет предлагаемой статьи.
1) Гремучекислые соли были открыты в 1800 г. Говардом, который, нагревая смесь спирта и азотной кислоты с азотнокислыми солями ртути и серебра, получил взрывчатые соли — ртутную HgC2N2O2 и серебряную Ag2C2N2O2. Соли других металлов получаются, исходя из ртутной и серебряной, посредством замещения в них металла. Измельченные железо Fе, цинк Zn, медь Cu вступают в такое замещение непосредственно при кипячении с HgC2N2O2, смешанною с водою:
HgC2N2O2 + Cu = CuC2N2O2 + Hg.
Щелочные и щелочноземельные металлы могут быть взяты в виде водных окисей (щелочей) МОН или сернистых соединений M2S; но при этом происходит замещение только вполовину, и образуются двойные соли:
2Ag2C2N2O2 + 2КНО = 2КАgC2N2O2 + Ag2O + H2O.
Двойные соли при действии слабой азотной кислоты превращаются в кислые, наприм., AgKC2N2O2 в AgHC2N2O2. Чтобы получить средние соли щелочных металлов, необходимо действовать, как показал в последнее время Эренберг (1886), амальгамами этих металлов; так, при действии амальгамы натрия на водный раствор HgC2N2O2 получается натриевая соль, кристаллизующаяся в соединении с водою NaC2N2O2 ·2H2O Что касается самой Г. кислоты HC2N2O2, отвечающей приведенным солям, то она столь непрочна, что до сего времени ее не могли даже получить с достоверностью в свободном состоянии [Шольвин (1886), действуя на раствор натриевой соли разведенною серной кислотой, по-видимому, достиг выделения гремучей кислоты в свободном состоянии, так как доказал присутствие ее в растворе по образованию серебряной соли. — Ч.] В настоящее время исходные соли, ртутная и серебряная, приготовляются помощию той же реакции, посредством которой Говард получил их в первый раз: берут по возможности маловодный спирт C2H5(HO), умеренной крепости азотную кислоту HNO3 и, растворив в последней ртуть или серебро [при чем образуются азотнокислые соли Hg(NO3)2 и AgNO3 ], все смешивают между собою при слабом нагревании; по окончании реакции образовавшиеся соли получаются в осадке. Пропорции, в которых берутся первоначальные вещества для приготовления ртутной соли, варьируют (очень близко) около следующей: на 1 весовую часть металлической ртути — 10 вес. ч. азотной кислоты и 10 в. ч. спирта. По способу Либиха, несколько измененному в последнее время Бекманом (1886), 1 вес. часть ртути растворяется в 12 вес. ч. азотной кислоты уд. веса 1,4, и отмериваются в другом сосуде 11 в. ч. 98% спирта. Доведя ту и другую жидкость до температуры в 25°-30°, половину спирта вливают в раствор ртути. Почти тотчас же наступает реакция, сопровождающаяся выделением белых и едких паров, а также переменой цвета раствора в бурый. Как только жидкость из светло-желтой начнет делаться красно-бурою, подливают постепенно вторую половину спирта и тем умеряют реакцию. Подливание должно производить не очень быстро (происходит выделение части ртути в свободном состоянии), но и не медленно (реакция может сделаться слишком бурной, начнут выделяться красно-бурые пары окислов азота, и жидкость может выброситься из сосуда). В последнем случае реакцию можно умерять, приливая холодной воды. Гремучая ртуть, получаемая этим способом, обыкновенно представляет сероватый осадок (между тем как в чистом состоянии она бела); такой цвет обусловливается незначительной подмесью металлической ртути.
По способу Шанделона, также в последнее время несколько измененному Лобри-де-Брюйном (1886), предпочитают применять обратный порядок смешения: растворив 1 в. ч. ртути в 12 в. ч. азотной кислоты уд. веса 1,35 и нагрев. раствор до 70°, приливают его при постоянном размешивании к 10 в. ч. 90° спирта в объемистой колбе. Если реакция не начинается сама собою, колбу подогревают на водяной бане до начала выделения белых паров и потом оставляют стоять при комнатной температуре, снабдив колбу длинной трубкою, служащей обратным холодильником. Хотя реакция и здесь идет довольно бурно, но красно-бурых паров совсем не получается, и постепенно осаждающаяся гремучая ртуть является совершенно белою. Такое значение порядка смешения объясняют тем, что азотистая кислота HNO2 содержащаяся в азотнокислом растворе ртути и обладающая более сильными окислительными свойствами, в последнем способе дает с избытком спирта азотистоэтиловый эфир C2H5NOO и потому не действует как окислитель, при обратном же приливании и она является в большем избытке вначале и усиливает окисление спирта. При осуществлении описанной реакции необходимо принимать предосторожности, чтобы не зажечь выделяющиеся пары, — тогда может произойти взрыв. Производят приготовление обыкновенно небольшими порциями, беря в работу в лабораториях не более 100 гр. металлической ртути. Гремучая ртуть почти так же приготовляется и на капсюльных заводах. Заводский процесс, применяемый на нашем капсюльном заводе в С.-Петербурге, в общем походит на второй из вышеописанных, причем в работу берется по 450 гр. ртути. Получающиеся при реакции пары отводятся в хорошо охлаждаемый приемник. Так как в сгустившейся в приемнике жидкости содержится много спирта и альдегида C2H4O вместе с разнообразными органическими кислотами, то, насытив последние известью, спирт и альдегид отгоняют и вновь употребляют для приготовления гремучей ртути, беря вместо чистого спирта смесь его с 1/5 по объему полученного отгона. Получаемая описанными способами, гремучая ртуть является в виде более или менее серого нерастворимого осадка. Очищение ее состоит в промывании водою до нейтральной реакции, после чего она сохраняется обыкновенно во влажном состоянии. Если желают очистить гремучую ртуть от примеси металлической ртути, то достаточно растворить ее в синеродистом калии KCN, с которым она образует растворимую двойную соль Hg2C2N2O2·KCN, и, профильтровав раствор, разложить его действием разведенной азотной кислоты; тогда KCN превратятся в селитру KNO3 с выделением синильной кислоты HCN, а гремучая ртуть выделяется в виде снежно-белого осадка. В неочищенной соли, кроме металлической ртути, может содержаться еще щавелевокислая соль HgC2O4, а именно — в случаях очень сильного окисления во время приготовления. Так как содержание ртути в Г. соли 70,42%, а в щавелевой 69,4%, то простое определение этого металла анализом не может дать точного представления о степени чистоты получаемого продукта. Поэтому при анализе должно поступать следующим образом: растворив сырую гремучую ртуть в едком аммиаке, отфильтровывают металлическую ртуть, если она замечается, и дозируют ее; фильтрат осаждается сернистым аммонием (NH4)2S и взвешивается осажденная сернистая ртуть HgS; новый фильтрат от HgS по прибавлении хлористого аммония осаждается хлористым кальцием СаCl 2 и по количеству полученного щавелевокислого кальция СаС 2O4 вычисляется содержание HgС 2O4. Но обыкновенно количество означенных примесей бывает очень незначительно и не влияет существенно на свойства соли при ее применениях в практике. Бертело и Вьейль, определяя в продажной (сероватой) Г. соли ртуть в виде HgS, a прочие элементы посредством газового анализа продуктов взрыва в бомбе, получили следующие данные:
|
Опытные |
Теоретические |
|
| Hg |
71,30 |
70,42 |
| С |
8,35 |
8,45 |
| N |
9,60 |
9,86 |
| О |
11,05 |
11,27 |
|
100,30 |
100,00 |
Как очищенная, так и не очищенная гремучая ртуть представляет легкие игольчатые кристаллы удельного веса 4,42, металлического вкуса, ядовитые, нерастворимые в холодной воде, но растворимые в 130 частях кипящей воды и во многих химических реагентах (напр. KCN, HCl, NH3 и др.).
Для приготовления гремучего серебра, по Либиху, растворяют 1 в. ч. серебра в 20 в. ч. HNO 3 удельного веса 1,36 и, прибавив раствор к 27 в. ч. 86% спирта, осторожно нагревают до начала реакции; тогда приливают еще 27 в. ч. спирта и оставляют стоять при обыкновенной температуре. Гремучее серебро выделяется в виде мелких белых, непрозрачных, шелковистых игл, мало растворимых в холодной воде и довольно хорошо в горячей (1 в. ч. соли в 36 в. ч. воды).
2) Но спрашивается, вследствие каких именно превращений при взаимодействии спирта, азотной кислоты и азотнокислых солей ртути или серебра получаются описанные Г. соли? Ответ на этот вопрос приводит к рассмотрению конституции самой гремучей кислоты. Кекуле (1857 г.) предложил рассматривать гремучую кислоту как нитрил нитроуксусной кислоты, или нитроацетонитрил CH2(NO2)CN = H2C2N2O2. Основанием для этого служили следующие свойства Г. солей. Влажная гремучая ртуть при действии хлора дает хлористый циан CNCl и хлорпикрин CCl3(NO2), т. е. болотный газ, в котором 3 атома водорода замещены хлором, а четвертый нитрогруппою:
HgC2N2O2 + 3Cl2 = HgCl3 + CNCl + CCl3(NO2).
При действии брома, кроме подобных же бромистых соединений, образуется еще двубромонитроацетонитрил CBr2(NO2)CN, т. е., изображая гремучую ртуть формулой CHg(NO2)CN, имеем в этом отношении полную ее аналогию с металлическими производными предельных нитроуглеводородов:
CH3CHNa(NO2) [натрий-нитроэтан] + Br2 = NaBr + CH3CHBr(NO2) [бромонитроэтан]
CHg(NO2)CN + 2Br2 = HgBr2 + CBr2(NO2)CN.
Как и для предельных нитроуглеводородов, кислый характер нитроацегонитрила обусловливается присутствием нитрогруппы, соединенной с тем же атомом углерода, с которым находится в соединении замещаемый металлами водород. С точки зрения Кекуле, при образовании Г. солей, очевидно, должны происходить не только окисление спирта азотной кислотой, нитрование, но и дегидратация, ибо нитроацетонитрилу CH2(NO2)CN отвечает ацетонитрил CH3CN, а последний происходит из уксусноаммиачной соли CH3CO(NH4O) выделением воды:
СН 3CO(NH4O) — 2H2O = CH3CN.
Уксусная кислота действительно находится в числе продуктов окисления спирта; происхождение же аммиака, необходимого для образования нитрила, понимается из того, что азотная кислота при действии восстановляющих веществ во многих случаях дает аммиак. Следовательно, по этому взгляду, процесс образования гремучей кислоты из спирта и азотной кислоты проходит через фазы: образование NH3, CH3COHO; затем получение CH3CN и , наконец, превращение CH3CN в CH2(NO2)CN.
Л. Н. Шишков (1861 г.) показал, что превращение Г. солей в соединения, содержащих нитрогруппы и циан, может последовательно привести к получению: тринитроацетонитрила C(NO2)3CN, не заключающего в себе водорода и потому неспособного давать соли, двунитроацетонитрила CH(NO2)2CN — вещества кислого и др., но что это достигается только переходя через фульминуровую кислоту C3H3N3O3, конституция которой собственно неизвестна, т. е. все подобные превращения являются результатом нескольких последовательных реакций и потому не доказывают еще, что сама гремучая кислота есть однонитроацетонитрил; скорее можно предположить, что последний содержится в сочетании с циановой кислотой NCHO в фульминуровой кислоте. По мнению Шишкова, гремучая кислота есть соединение двух частиц синильной кислоты 2HCN двунитроэтиленом C2H2(NO2)2, и Г. соли вообще выражаются формулой C2M3(NO2)22MCN. Что она во всяком случае не есть нитроацетонитрид — это в настоящее время не подлежит никакому сомнению, ибо последний был получен в свободном состоянии действием серной кислоты на фульминуровую кислоту и с гремучей кислотою оказался не имеющим ничего общего, кроме элементарного состава (Штейнер — 1883 г.). В пользу своей формулы Шишков приводит следующие свойства Г. солей, не объяснимые формулой Кекуле: 1) при действии кислот они выделяют в большей или меньшей степени синильную кислоту; 2) водород гремучей кислоты представляет различное отношение к металлам, а именно — одна половина его (вероятно, этиленная) легче замещается щелочными металлами и может оставаться незамещенной в кислых солях (см. начало статьи); 3) при образовании Г. солей всегда замечается синильная кислота. По этому взгляду, происхождение гремучей кислоты есть результат образования HCN, разложения спирта на этилен C2H4 и воду и нитрования этилена; притом окисление спирта азотной кислотою является нужным лишь постольку, поскольку требуется HCN, так что в случае предварительного введения в реакцию синеродистых солей оно должно было бы сделаться излишним.
Г. соли в большинстве их превращений дают соединения, заключающие в своем составе по одному атому углерода; так, кроме вышеуказанных реакций, известны следующие. При действии сернистого водорода гремучая ртуть дает родановую кислоту CNHS:
HgC2N2O2 + 3Н 2S = HgS + 2Н 2O + 2CNHS.
Особенно примечательно действие дымящейся соляной кислоты HCl: Г. соли при этом почти нацело разлагаются на муравьиную кислоту НСОHО и гидроксиламин NH2(HO), образующий с HCl хлористоводородную соль (Карстаньен, Штейнер, Дэбверс и др. от 1883 до 1887 г.):
HgC2N2O2 + 4HCl + 4H2O = HgCl2 + 2HCOHO + 2NH2(НО)НСl.
Подобным образом реагируют и многие другие кислоты, напр. иодистоводородная HJ, родановая HCNS и т. п. Но эти превращения не объяснимы ни формулой Кекуле, ни формулой Шишкова, почему они послужили основанием для рассматривания конституции гремучей кислоты еще с новых точек зрения [Превращение половины гремучей кислоты в гидроксиламин еще можно было бы объяснить при помощи обеих этих формул, так как половина азота в них входит в виде (NО 2), а В. Мейер на предельных нитроуглеводородах показал, что они при действии дымящейся HCl также выделяют свой азот в виде гидроксиламина: CH3CH2(NO2) + H2O = CH3COHO + NH2(HO); но в том и дело, что Г. соли при этой реакции весь свой азот выделяют в виде NH 2(HO), между тем как превращение азота циана в этот продукт до сих пор нигде не наблюдается. — Ч.]. Если отбросить различия в исходных точках, то все высказанные в последнее время в этом отношении взгляды могут быть сведены окончательно к тому, что гремучая кислота есть продукт окисления (с потерей двух атомов водорода) так назыв. глюксима (НО)HNC-CNH(НО) (см. Оксимы), происходящего взаимодействием глиоксаля HCO-COH (см.) (альдегидного вещества), с одной стороны, и гидроксиламина, с другой:
НОС-COH + 2NH 2(HO) = (HO)HNC-CNH(HO) + 2Н 2O.
В самом деле, при окислении спирта азотной кислотою происхождение этого соединения представляется более естественным, чем нитроацетонитрила или соединения двунитроэтилена с синильной кислотою, так как глиоксаль таким именно образом и получается, а раскисление азотной кислоты в кислых жидкостях чаще всего идет только до гидроксиламина, образование же оксимов совершается с такою легкостью, что служит одним из наиболее характерных свойств альдегидных веществ. При дальнейшем окислении глюксима через потерю 2 атомов водорода в виде воды и получается гремучая кислота:
Что касается того, какие именно атомы водорода подвергаются окислению, то в
этом отношении исследователи расходятся между собою. По мнению Штейнера,
окисляется водород, соединенный с углеродом, т. е. конституция гремучей кислоты
выражается формулой
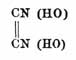 . Шолль
изображает ее как перекись глиоксима
. Шолль
изображает ее как перекись глиоксима
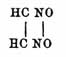 , т. е.
принимает окисление водорода гидроксиламинного. По Дэйверсу, происходит ангидрид
глюксима и окисление одного атома улеводородного водорода в водный остаток, т.
е.
, т. е.
принимает окисление водорода гидроксиламинного. По Дэйверсу, происходит ангидрид
глюксима и окисление одного атома улеводородного водорода в водный остаток, т.
е. 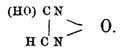 . Все эти
формулы в большей или меньшей степени могут объяснить всякие превращения
гремучей кислоты. Возьмем, например, формулу Штейнера: она представляет
двууплотненный карбонилоксим, т. е. оксим, отвечающий окиси углерода, C"N(OH).
При реакции с соляной кислотой наступает гидратация обоих карбонилоксимов:
. Все эти
формулы в большей или меньшей степени могут объяснить всякие превращения
гремучей кислоты. Возьмем, например, формулу Штейнера: она представляет
двууплотненный карбонилоксим, т. е. оксим, отвечающий окиси углерода, C"N(OH).
При реакции с соляной кислотой наступает гидратация обоих карбонилоксимов:
C"N(OH) + 2H2O = HCOHO + NH2(OH).
При реакциях, в которых получаются производные уксусного нитрила, происходит
сначала отнятие воды, как для оксимов альдегидов, с образованием нитрилов
[Например, 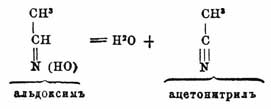 ]
и затем новое присоединение ее, но с другим расположением атомов:
]
и затем новое присоединение ее, но с другим расположением атомов:
Кислый характер обусловливается способностью водного водорода оксимов замещаться металлами и т. п.
Точное знание конституции гремучей кислоты позволило бы наиболее целесообразно обставлять реакцию их получения; но все, что можно заключить в этом отношении на основании сказанного, пока сводится только к необходимости сильного окислительного действия азотной кислоты на алкоголь; нет окисления — не образуется и гремучекислых соединений. Хотя в прежнее время предполагали (Либих), что гремучее серебро может образоваться при пропускании азотистого ангидрида в спиртовой раствор азотносеребряной соли по уравнению: С 2H5ОН + 2AgNO3 + N2O3 = Ag2C2N2O2 + 2HNO3 + 2Н 2О; но новейшие исследования (Дэйверс и Кавакита — 1884 г.) показали, что при этом реакция не происходит, так как образование азотистоэтилового эфира исключает возможность окисления спирта.
3) Взрывчатые свойства гремучекислых солей обусловливаются, с одной стороны, поглощением тепла при их образовании из элементов, с другой — присутствием окисленного азота (см. "Взрывчатые вещества"). Взрывчатое разложение происходит как при нагревании и действии электрической искры, так при ударе и трении, а также при соприкосновении с некоторыми сильными химическими реагентами, напр., с крепкими серной и азотной кислотами. Если гремучее серебро бросить осторожно в сосуд, наполненный хлором, то оно взрывается ранее, чем соприкоснется с дном и сосуд при этом не разбивается. Температура воспламенения гремучей ртути, по определению различных исследователей, лежит при 149°, 186° и 200°. В сухом состоянии она от умеренного удара и трения всегда взрывается между железными поверхностями, менее легко — между мраморными пластинками, весьма трудно — между железом и свинцом, совсем не взрывается между деревянными поверхностями; но во влажном состоянии ее можно считать достаточно безопасною, так как уже при содержании 5% влажности происходит взрыв только части, подвергшейся непосредственному удару, без передачи его соседним частям, а при 30% влажности не бывает даже и местного взрыва. Серебряная соль по отношению к удару и трению чувствительнее ртутной, ибо может взрываться и во влажном состоянии, напр. при растирании стеклянною палочкою под водою. Превращение в газы при воспламенении бывает почти мгновенное. Если поджечь на открытом воздухе небольшое количество порошкообразной сухой гремучей ртути, то происходит вспышка со слабым звуком, но достаточно завернуть ее в бумагу, чтобы звук при взрыве сделался сильным и резким. Иначе содержится при поджигании сильно спрессованная гремучая ртуть в открытой с одного конца латунной трубке: происходит постепенное превращение в газы с образованием пламени, и, чтобы взорвать ее в этом состоянии, нужно произвести удар помощью твердого тела или посредством быстро образующихся газов. Необходимо, однако, заметить, что все сказанное справедливо только по отношению к малым количествам (не превосходящим нескольких граммов) соли. Применение гремучей ртути в практике для приготовления запалов (см.) основано на том, что она при сравнительной безопасности обращения, во-первых, способна легко взрываться от умеренного удара, что дает весьма простое и в то же время верное средство для сообщения огня взрывчатым зарядам, во-вторых, развивает мгновенно при взрыве такие громадные давления, что является в настоящее время почти единственным веществом, пригодным для возбуждения так наз. детонации (см. Взрывчатые вещества). В последнем отношении исследования Бертело и Вьейля (1880) дали следующие результаты. Гремучая ртуть образована из Hg (жид.), N2 (газ.), О 2 (газ.) и С 2 (алмаза) с поглощением тепла — 62,9 Кал., и 1 кг ее дает при нормальных условиях газов: 314 литр. (Hg газ.) или 235,8 литр. (Hg жид.), точно соответствующих по своему составу уравнению разложения:
HgC2N2O2 = Hg + 2СО + N2,
с отделением тепла при постоянном объеме +356 Кал. (Hg газ.) или +408 Кал. (Hg жид.), а при постоянном давлении +349 Кал. (Hg газ.) или +403 Кал. (Hg жид.). При плотностях заряжания Δ = 0,2 и 0,3 в бомбе получаются соответственные давления p = 1183 и 1771 килогр. на 1 кв. см, которые вообще значительно меньше, чем для многих других взрывчатых веществ при тех же плотностях заряжания. Своим преимуществом в отношении силы производимого при взрыве удара, необходимого для возбуждения детонации, гремучая ртуть обязана исключительно своему большому удельному весу 4,42 и способности мгновенного разложения: при наибольшей плотности заряжания, определяемой этим удельным весом, предельный (наименьший) объем газов (когда они, подобно жидкой воде, почти не сжимаемы) будет по крайней мере в 1,6 раза больше объема, занимаемого твердой солью, а потому должны развиться мгновенные давления выше всякой измеряемой величины. (См. Взрывчатые вещества).
И. М. Чельцов. Δ .
|
Page was updated:Tuesday, 11-Sep-2012 18:15:07 MSK |