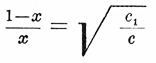
| [ начало ] | [ Ж ] |
Жадность
(хим.; нем. Avidität) — термин, употребленный в первый раз Томсеном для обозначения стремления кислоты к нейтрализации основанием в сильно разбавленном водном растворе. Это есть коэффициент, показывающий распределение основания между двумя конкурирующими кислотами, взятыми в эквивалентных количествах. Если, например, Ж. серной кислоты относительно едкого натра, принимая Ж. соляной кислоты относительно того же основания за единицу, по определениям Томсена, равна 0, 4 9, а соответствующая величина для монохлоруксусной кислоты 0,09, то это значит, что реакция в эквивалентных количествах серной кислоты на монохлороуксуснонатриевую соль или, обратно, серно-натриевой соли на монохлоруксусную кислоту не пойдет до конца; в растворе установится равновесие, при котором распределение едкого натра таково, что на 0,49 весовых частей его в соединении с серной кислотой будет приходиться 0,09 весовых частей его в соединении с монохлоруксусной кислотой. Принимая за единицу все количество едкого натра, входящего в реакцию, а за x - количество его, соединившееся с монохлоруксусной кислотой, будем иметь в соединении с серной кислотой 1- x и, согласно жадностям указанных кислот, получим следующее соотношение: (1-x)/x=0,49/0,09, откуда x=155, или, другими словами, 15,5% едкого натра соединятся с монохлоруксусной, а остальные 84,5% — с серной кислотой. Определение Ж. кислот сводится к изучению распределения основания в водном растворе между двумя конкурирующими кислотами. О распределении же судят по изменению тех или иных физических свойств растворов, между которыми происходит взаимодействие. Такими физическими свойствами растворов являются теплота смешения (термохимический метод), удельный вес и обратная ему величина — удельный объем (объемно-химический метод), показатель преломления, вращение плоскости поляризации и т. п. Сущность подобных приемов состоит в определении величины данного свойства смеси растворов средней соли какой-нибудь кислоты с другой свободной кислотой в эквивалентных количествах. Отсюда, зная величину данного физического свойства для того случая, если бы реакция шла до конца, рассчитывается, какая доля наблюденного изменения этой величины обусловлена образованием средней соли одной и средней соли другой кислоты. Следующая таблица содержит величины жадностей некоторых кислот, определенные Оствальдом объемно-химическим путем (первый столбец) и Томсеном из измерений теплоты смешения (второй столбец).
| Азотная кислота | 1,00 | 1,00 |
| Соляная кислота | 0,98 | 1,00 |
| Монохлоруксусная кислота | 0,070 | 0,09 |
| Уксусная кислота | 0,0123 | 0,03 |
| Винная кислота | 0,052 | 0,05 |
При определении Ж. на первый план выступает вопрос о влиянии на распределение природы основания. Томсен, определявший Ж. термохимическим путем, пришел к заключению, что распределение основания между двумя конкурирующими кислотами различно, смотря по природе основания. Так, например, отношение Ж. азотной и серной кислот равно 2 по отношению к едкому кали, 1,88 для аммиака и 1,61 — в случае цинка. Многочисленные исследования, произведенные объемно-химическим путем, а также при помощи показателя преломления (Оствальдом в 1878 г.), показали, что отношение Ж. не зависит от природы основания. Оствальд исследовал распределение многих кислот относительно едкого кали, натра и аммиака, и во всех исследованных случаях расхождения между числами относительного распределения для разных оснований лежат в пределах ошибки наблюдения.
Величина Ж., являясь постоянной для данной кислоты, принимается (Томсен и Оствальд) характеризующей меру сродства этой кислоты к основанию. Но свойства кислот производить действие, определяемое Ж., не ограничивается только образованием солей. Существуют реакции, происходящие также при действии кислот и определяемые некоторыми числовыми коэффициентами. Такими реакциями являются, например, разложение ацетамида, разложение сложных эфиров, инверсия (см.) сахара и т. п. Действие кислот в этих случаях характеризуется скоростью указанных реакций. Необходимо ожидать ближайшего соотношения между величинами жадностей и коэффициентами скоростей, как числами, характеризующими свойства кислот. В статье о химических равновесиях будет доказано, что связь эта выражается следующим образом: коэффициенты распределения относятся между собой как квадратные корни из коэффициентов скоростей. Если 1 -x есть та часть нейтральной соли, которая осталась при прибавлении кислоты неизмененной, и вместе с тем это есть часть основания, удержанная кислотой нейтральной соли, а x — количество основания, соединившееся с прибавленной кислотой, то, согласно сказанному:
где с 1/ с есть отношение коэффициентов скоростей реакций конкурирующих кислот. Таким образом, величину жадности можно определять и на основании указанного соотношения. Порядок величин, как показали измерения Оствальда, остается один и тот же, особенно если брать измерения скоростей разложения ацетамида. Отсюда может быть сделан тот общий вывод, что действие кислот определяется известными коэффициентами, независимыми от особенностей химического процесса [Спрашивается теперь, являются ли величины жадностей действительно мерой сродства (см.) кислот к основанию? Вопрос этот, по-видимому, должен быть решен в отрицательном смысле. Изучаемые явления, в сущности, более сложны, чем кажется на первый взгляд, а именно благодаря влиянию воды, в среде которой они происходят. Вода не может оставаться недеятельной средой и, без сомнения, влияние ее здесь громадно, так как масса ее велика. Не воздействие кислоты на щелочь, а, быть может, воздействие воды производит те явления, из которых Оствальд и Томсен заключают о мере солеобразования (см. Д. Менделеев, "Исследование водных растворов", 1887, стр. 20-22). В. К. ].
В. Курилов. Δ .
|
Page was updated:Tuesday, 11-Sep-2012 18:15:17 MSK |