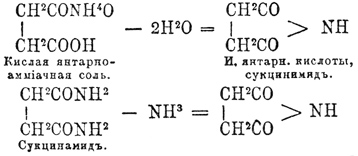
| [ начало ] | [ И ] |
Имиды
(хим.) — составляют особую форму кислотных амидов (см.), свойственную многоосновным органическим кислотам, представляя продукты замещения в них каждых двух кислотных водных остатков двуэквивалентной группой (NH)". И. двухосновных кислот происходят через выделение двух частиц воды из частицы кислой аммиачной соли или одной частицы аммиака из частицы амида, например:
Подобным же образом происходят и И. кислот большей основности, напр. так называемый парамид, представляющий триимид шестиосновной меллитовой кислоты:
В последнем случае, очевидно, возможны смешанные имидно-кислотные, имидно-амидн. и имидно-амидно-кислотные формы, представителями которых, напр. для той же меллитовой кислоты, являются эвхроновая кислота
и парамидная кислота
Не все многоосновные кислоты способны образовать И. При образовании И., так
же как и при образовании ангидридов кислот, происходит замыкание открытой цепи
углеродных атомов, а такое замыкание по преимуществу свойственно четырех— и
пятичленным открытым цепям, способным дать при этом пяти— и шестичленные
замкнутые группировки (см. формулу сукцинимида). С точки зрения стереохимической
гипотезы это обстоятельство объясняется тем, что только при образовании пяти— и
шестичленных кольцеобразных систем не происходит или же происходит лишь малое
отклонение (Ablenkung) направлений сродств углеродных атомов. И действительно,
из предельных двухосновных кислот И. известны лишь для этиленянтарной кислоты
СОНОСН 2CH2 СОНО,
глутаровой СОНОСН 2 CН 2 CН 2 CОНО
и их прямых гомологов, для кот. получены и ангидриды, тогда как малоновая СОНОСН 2 CОНО,
адипиновая СОНО(CН 2)4 СОНО
(см.) и др. к образованию И., равно как и ангидридов, оказываются неспособными.
Для щавелевой кислоты (см.) Ост и Менте (1886) получили при нагревании
оксаминовой кислоты с пятихлористым фосфором кристаллическое вещество, имеющее
состав И. щавелевой кислоты (СО) 2 NН,
которому они приписывают строение
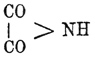 , но так как
частичный вес этого вещества не был определен и так как оно при гидратации
распадается на оксамид NH 2COCONH2
и щавелевую кислоту ОНСОСОНО, то в нем можно скорее видеть полимер оксимида
строения
, но так как
частичный вес этого вещества не был определен и так как оно при гидратации
распадается на оксамид NH 2COCONH2
и щавелевую кислоту ОНСОСОНО, то в нем можно скорее видеть полимер оксимида
строения 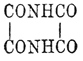 .
Из двухосновных кислот непредельных И. получаются также лишь для тех, которые
способны образовать ангидриды. Таковы кислоты: малеиновая, цитраконовая,
камфорная, ортофталевая (см. Фталевая) и др. При непредельных кислотах во многих
случаях, помимо вышеприведенных соображений, несуществование И., как и
ангидридов, для той или другой кислоты находит, по-видимому, объяснение в их
геометрической конфигурации (см. Стереоизомерия).
.
Из двухосновных кислот непредельных И. получаются также лишь для тех, которые
способны образовать ангидриды. Таковы кислоты: малеиновая, цитраконовая,
камфорная, ортофталевая (см. Фталевая) и др. При непредельных кислотах во многих
случаях, помимо вышеприведенных соображений, несуществование И., как и
ангидридов, для той или другой кислоты находит, по-видимому, объяснение в их
геометрической конфигурации (см. Стереоизомерия).
И. изомерны первым нитрилам двухосновных кислот (цианозамещенным одноосновным кислотам): например, сукцинимид изомерен с β-цианопропионовой кислотой CNCH 2CH2 COHO. Присутствие в их составе группы NH явствует из существования замещенных И. (см. далее), образующихся через потерю воды из соответствующих кислых солей первичных аминов (а также при действии йодюров на металлические производные И.) и при гидрации распадающихся на соответствующую кислоту и первичный амин. С другой стороны, нейтральные свойства И. указывают на отсутствие в них карбоксила -СООН. Строение И. обыкновенно принимается симметрическим, т. е. двуэквивалентная группа NH, замещающая два водных остатка двух карбоксилов, является связанною своими двумя сродствами с обоими карбоксильными атомами углерода. Такое строение для сукцин— и глутаримида доказывается восстановлением первого натрием в спиртовом растворе в пироллидине и образованием второго при окислении пиперидина перекисью водорода по уравнению:
Другое возможное для И. несимметрическое строение приписывается Вислиценусом (1887) И. фталевой кислоты, которому он вместо обычной сим. формулы C 6H4(CO)2 NH дает формулу C 6H4 CO(C=NH)O, основываясь на образовании его из амида фталевой кисл., полученного действием аммиака на фталилмалоновый эфир несимметричного строения.
И. получаются сухой перегонкой кислых аммиачных солей двухосновных кислот или соответствующих амидов (уравн. см. выше), а также действием аммиака на ангидриды двухосновных кислот (Лоран, д'Арсе, Фелинг, Готтлиб и др.). С помощью последнего способа и был открыт д'Арсе (1835) первый из И. сукцинимид: С 2H4 (СО) 2 О + NH 3 = C2H4(CO)2NH + H2 O. Интересные случаи образования представляют некоторые И. непредельных кислот. Так, фталимид был получен Зандмейером (1885) через изомеризацию ортоцианобензойной кислоты при сохранении ее в присутствии воды: С 6H4 (СN)СОНО = C 6H4(CO)2 NH, а гемипинимид Либерманном (1886) с помощью изомеризации опианоксимангидрида, происходящей с большим отделением тепла (52,6 больш. калор.) при плавлении его:
(см. Опиановая кислота). Аналогично последнему и наблюденное Расином превращение при нагревании фталоксимовой (изонитрозотолуиловой) кислоты во фталимид, сопровождающееся также значительным внешним тепловым эффектом: C 6H4∙(COHO)(CH=NOH) = C6H4(CO)2 NH + Н 2 O. Еще более любопытно образование камфоримида и дифенимида из изонитрозокамфоры и изонитрозофенантренхинона изомеризацией, совершающейся под влиянием крепких кислот, соляной или серной, и сопровождающейся разрывом углеродной связи, как это видно из формул (Классен, Манассе, Анжели, 1893):
И. представляют кристаллические вещества, плавящиеся, возгоняющиеся и перегоняющиеся без разложения, большею частью хорошо растворимые в воде и спирте, а многие более или менее и в других обычных растворителях. Представляя продукты дегидратации кислых аммиачных солей, И., подобно другим формам амидов, при нагревании с водными растворами едких щелочей и кислот легко обратно присоединяют воду, разлагаясь при этом на аммиак и соответствующие кислоты или соли, напр.:
С 2H4 (СО) 2NH + 2H2O = C2H4(COHO)2 + NH3.
Основания менее энергичные, как известь, барит, окись свинца, переводят при этом их в аминовые кислоты по уравнению:
C2H4(CO)2NH + H2O = C2H4(CONH2)(COHO).
С аммиаком при нагревании И. соединяются, превращаясь в амиды, напр.:
C2H4(CO)2NH + NH3 = C2H4(CONH2)2.
И. способны прямо соединяться с изоциановыми эфирами, образуя при этом однозамещенные уреиды, наприм.: CONCH 3 + C2H4(CO)2NH = C2H4(CO)2(NH)(NCH3)CO (Метилсукцинилмочевина) (Meншyткин, 1876).
Соединений с кислотами они не образуют и реагируют на лакмус нейтрально. Аммиачный водород И. легко замещается металлами, при чем образуются солеобразные производные, способные, подобно настоящим солям, вступать в двойные соляные разложения. Особенно много исследовано металлических производных для сукцин— и фталимида. Известны соединения И. как с тяжелыми металлами, так и со щелочными и щелочноземельными, представляющие большею частью растворимые в воде кристаллические вещества, из которых многие содержат кристаллизационную воду. Щелочные производные получаются действием спиртовых растворов щелочей на И., а прочие из щелочных — обменным разложением их с соответствующими солями. Серебряные производные получаются, кроме того, при действии на И. окиси или азотнокислого серебра в присутствии аммиака. Состав, напр., калиевого и серебряного производных сукцинимида отвечает формулам:
С 2H4(CO)2NK + 1/2 Н 2 O и C 2H4(CO)2 NAg или C 2H4(CO)2NAg + 1/2H2O.
При действии йодюров спиртов на щелочные производные И. и при перегонке кислых солей аминов получаются алкилированные И., т. е. И., в которых водород группы NH замещен углеводородными остатками; последнее доказывается как реакцией получения их из солей аминов, так и распадением под влиянием щелочей на соответствующие кислоты и амины. Таковы, например, метилсукцинимид C 2H4(CO)2NCH3, фенилсукцинимид C 2H4(CO)2NC6H5 и др. Это — кристаллические вещества, способные плавиться и перегоняться без разложения, как и сами И. [При действии йодюров на серебряное производное сукцинимида, не содержащее крист. воды, Комшток и Веелер (1893) получили изомерные этим вещества в виде жидкостей, при действии влажности разлагающихся на сукцинимид и спирты.]. Водород группы NH в имидах способен, наконец, замещаться галоидами, причем образуются кристаллические галоидные производные. Так, при действии йода на серебряное производное сукцинимида получен сукциниодимид С 2H4 (СО) 2 NJ, а при действии на сукцинимид хлорноватистой и бромноватистой кислот получены соответствующие хлористое С 2H4 (СО) 2 NCl и бромистое C 2H4(CO)2 NBr соединения.
П. П. Рубцов. Δ .