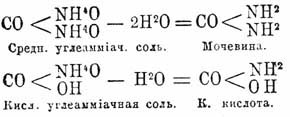
| [ начало ] | [ К ] |
Карбаминовая кислота
(хим.) — представляет первый амид угольной кислоты и имеет состав CO(NH 2)OH. Если производить амиды от аммиачных солей через потерю ими частиц воды, то средняя углеаммиачная соль, теряя 2 частицы воды, даст полный амид угольной кислоты, карбамид, или мочевину (см.), при потере же воды (именно одной ее частицы) кислой углеаммиачной солью получится К. кислота. Эти отношения выражаются следующими уравнениями:
К. кислота в свободном состоянии неизвестна, но известны ее соли, эфиры (уретаны) и хлорангидрид. Из солей наиболее важна карбаминово-аммиачная соль CO(NH2)NH4 O. Она образуется прямым соединением газообразных углекислоты и аммиака (по уравнению: CO 2 + 2NH3 = CO(NH2)NH4 O) и потому входит в состав продажной углеаммиачной соли (см.), ибо при заводском получении последней с помощью прокаливания смеси нашатыря или серно-аммиачной соли с мелом (СаСО 3) имеются условия как для развития свободных СО 2 и NH 3, так и для их соединения по вышенаписанному уравнению. В чистом виде ее удобно получать, по Базарову, пропуская сухие СО 2 и NH 3 в абсолютный спирт при охлаждении, при чем она осаждается в виде кристаллического порошка. Карбаминово-аммиачная соль кристаллизуется в листочках, издающих запах аммиака и притягивающих влагу из воздуха. Она представляет вещество малопрочное, легко разлагающееся на воздухе на свои компоненты, углекислоту и аммиак (отчего и пахнет аммиаком), а в водных растворах — на холоду постепенно, при нагревании же быстро переходящее в углеаммиачную соль (CO(NH 2)ONH4 + H2O = CO(NH4O)2). Диссоциация карбаминово-аммиачной соли начинается уже значительно ниже 0°; при 15° упругость диссоциации ее равна 26 мм, а при 60° — 770 мм (Naumann). Определение плотности пара, сделанное Науманом при 37°, показывает, что уже при этой температуре карбаминово-аммиачная соль в парах является вполне разложенною на СО 2 и 2NH 3. Из исследований Изамбера следует, что и при более низких температурах, т. е. вообще в парообразном состоянии, карбаминово-аммиачная соль не существует. Кислоты чрезвычайно энергично разлагают ее с выделением углекислоты:
CO(NH2)NH4 + 2HCl = 2NH4Cl + CO2
а щелочи переводят в углекислую соль, выделяя аммиак:
CO(NH2)NH4O + KHO= KHCO3 + 2NH3.
При нагревании в запаянной трубке при 130° — 140° карбаминово-аммиачная соль превращается в мочевину:
СО(NH 2)NH4O = (NH2)CO + H2 O (Базаров).
Из других солей К. кислоты известны соли щелочных и щелочноземельных металлов. Все они легко растворимы в воде и весьма непостоянны. Если к слабому водному раствору карбаминово-аммиачной соли прибавить слабого раствора хлористого кальция, то осадка, по причине растворимости карбаминово-кальциевой соли, не образуется, но при стоянии раствор мутится вследствие постепенного превращения К. соли в углекислую и осаждения последней. Если пропускать углекислоту в водный раствор аммиака и затем прибавить СаСl 2, то осадка СаСО 3 также не образуется, откуда явствует, что и в этих условиях (в присутствии воды) соединение NH 3 и СО 2 сопровождается образованием сперва не углекислой, а карбаминовокислой соли.
Хлорангидрид К. кислоты CO(NH2)Cl получается при действии сухого хлористого водорода на циановокислые соли (W ö hler, 1843), напр.:
AgCNO + 2HCl = AgCl + CO(NH2)Cl
или при действии фосгена (см.) на нашатырь при нагревании (Gattermann u. Schmidt, 1877) по ур.:
COCl2 + NH4Cl = CO(NH2)Cl + 2HCl.
Хлорангидрид представляет жидкость острого запаха, иногда является в форме призматических кристаллов с точкой пл. 50°, кипит при 60° — 62°, разлагается при этом вполне на хлористый водород и циановую кислоту, которые при охлаждении вновь соединяются, но лишь отчасти, так как главная масса циановой кислоты превращается при этом в циамелид (см.). Постепенное превращение в циамелид с потерей HCl происходит и при хранении при обыкновенной температуре. Водой хлорангидрид энергично разлагается на углекислоту и нашатырь:
CO(NH2)Cl + H2O = CO2 + NH4Cl;
со спиртами дает уретаны (см. ниже), или аллофановые эфиры (при избытке хлорангидрида); с аминами — замещенные мочевины:
CO(NH2)Cl + CH3NH2 = CO(NH2)(NHCH З) + HCl;
с ароматическими углеводородами и эфирами фенолов реагирует в присутствии хлористого алюминия, образуя амиды ароматических кислот (Gattermann u. Schmidt). Подобными же свойствами обладают и хлорангидриды замещенных К. кислот [Замещенные К. кислоты, CO(NHR)OH, подобно самой К. кислоте, в свободном состоянии не известны.], получаемые соединением изоциановых эфиров с хлористым водородом (Habich u. Limpncht) или при действии фосгена на нагретые хлористоводородные соли первичных аминов. При соответствующих превращениях эти хлорангидриды образуют соли аминов и замещенные уретаны, двузамещенные мочевины и замещенные амиды ароматических кислот, а при перегонке нацело распадаются на хлористый водород и изоциановые эфиры (см.), обратно сполна соединяющиеся при охлаждении. Хлорангидрид метилкарбаминовой кислоты CO(NH-CH 3)Cl кристалличен, плавится при 90° и кипит при 93° — 94°. Хлорангидрид этилкарбаминовой кислоты CO(NH-C 2H5)Cl жидок и кипит при 92°.
Карбаминовые эфиры, или уретаны, получаются действием аммиака на угольные (Саhours) или хлоругольные эфиры (Dumas):
CO(O-C2 Р 6)2 + NH3 = СО(NН 2)(О-С 2H6) + CO-Cl(O-CH3) + NH3 = CO(NH2)(O-CH З) + HCl;
соединением циановой кислоты со спиртами (Liebig u. W öhler):
CO-NH + C2H5-OH = CO(NH2)(O-C2H5);
взаимодействием спиртов с хлористым цианом (Wurtz):
CNCl + 2C2H5(HO) = CO(NH2)(O-C2H б) + C2H5Cl;
нагреванием мочевины с спиртами (Hofmann):
CO(NH2)2 + C2H5-OH = CO(NH2)(O-C2H6) + NH3;
действием на спирты хлорангидрида К. кислоты (Gattermann):
CO(NH2)Cl + C2H5-OH = CO(NH2)(O-C2H5) + HCl.
Уретаны представляют кристаллич. вещества, летучие без разложения, легко растворимые в воде, спирте и эфире. Карбаминово-метиловый эфир, или метиловый уретан, CO(NH 2)(OCH3), плавится при 52°, кипит при 177°; этиловый (обыкновенный) уретан CO(NH 2)(O-C2H6) плавится при 50° — 51° и кипит при 184°. При нагревании с аммиаком или аминами уретаны переходят в соответствующие мочевины; едким кали разлагаются на спирты и цианово-калиевую соль; соединяются с альдегидами при выделении частицы воды; при взаимодействии с хлорангидридами или ангидридами кислот образуют кристаллические продукты замещения аммиачного водорода кислотными радикалами, каков, напр., ацетилуретан CO(NH-C 2H3O)(O-C2H5) (темп. пл. 77° — 78°). При взаимодействии угольных или хлороугольных эфиров с аминами или спиртов с изоциановыми эфирами или хлорангидридами замещенных К. кислот получаются замещенные уретаны, из которых принадлежащие к жирному ряду суть жидкости, а к ароматическому — кристаллич. вещества. Метилуретан CO(NH-CH 3)(O-C2H5) кипит при 170°; фенилуретан CO(NH-C 6H5)(O-C2H5) плавится при 52° и кипит при 238°, отчасти разлагаясь на спирт и изоциановый фенил. Особенность замещенных уретанов составляет их способность образовать нитрозопроизводные (Clobbie, 1890) при действии азотистой и нитропроизводные (Franchimont et Clobbie, 1888) при действии безводной азотной кислоты. Таковы, напр., нитрозометилуретан CO(N-CH 3-NO)(O-C2H6) и нитрометилуретан CO(N-CH3-NO2)(O-C2H5). Нитроизопроизводные при действии аммиака разлагаются с выделением азота по уравн.:
CO(N-CH3-NO)(O-C2H5) + NH3 = CO(NH2)(O-C2H6) + СН 3 (ОН) + N 2
а нитроизопроизводные при этом распадаются с образованием нитроаминов:
CO(N-СН 3-NO2)(O-C2H5) + NН 3 = CO(NH2)(O-C2H5) + NH(CH3)NO3
нитрометидамин.
П. Рубцов. Δ .
|
Page was updated:Tuesday, 11-Sep-2012 18:15:29 MSK |