| [ начало ] | [ О ] |
Озон*
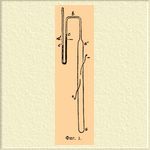
(хим., Ozon — нем., Ozone — франц. и англ.) — газообразное тело, представляет пока единственный случай аллотропического видоизменения элементарного газообразного вещества; это кислород, в частице которого не два атома, а три. Образование его из обыкновенного кислорода сопровождается, при очень значительном поглощении тепла, уменьшением объема на 1/3, что и выражается уравнением: 3О 2 = 2О 3. Характерная особенность О. — это его сильно повышенная способность производить реакции. Окисляя, О. превращается в обыкновенный кислород, например при реакции с йодистым калием в присутствии воды или водяного пара: О 3 + H2 O + 2KI = О 2 + 2KOH + I2; на окисление идет, следовательно, такое же количество кислорода, какое как бы исчезает при превращении кислорода в О. Так как в природе О. встречается только в малых количествах, а при искусственном получении никогда не удается превратить в него весь взятый кислород, то изучение О. принадлежит к числу трудных задач. Название ему дано (Шёнбейн) за очень значительную пахучесть (όςω — пахну). Впервые на О. обратил внимание (1785) Ван-Марум, заметивший, что если подвергнуть кислород действию электрических искр, то он приобретает характерный запах [Этот запах известен всем, кому случалось присутствовать при действии электрической машины, наблюдать её разряды в воздухе.] и способность действовать на ртуть при обыкновенной температуре, вследствие чего последняя теряет свой блеск и начинает прилипать к стеклу, окисляется. Затем (1840) Шёнбейн показал способность О. выделять йод из йодистого калия и производить многие другие реакции окисления. Оказалось, что это вещество находится также в кислороде, полученном при электролизе подкисленной воды, и развивается при соприкосновении воздуха с белым фосфором, полупокрытым водой, т. е. когда существует возможность медленного окисления последнего. Вообще можно сказать, что О. может возникнуть там, где, кислород образуется или потребляется, где, следовательно, можно предполагать мимолётное существование свободных атомов его. Но самый удобный способ для получения О. — действие тихого электрического разряда (без искр) на кислород или воздух; однако, и он не приводит к полному превращению; всегда наступает некоторый предел, получается смесь О. и кислорода; если же при этом будет присутствовать раствор йодистого калия, то постепенно весь кислород — через О. — можно соединить с калием и сделать йод свободным (Эндрюс). Что превращение кислорода в О. сопровождается уменьшением объема, доказано (Эндрюс и Тэт) при помощи трубки aa' (фиг. 1), снабженной манометром b с крепкой серной кислотой, на которую О. не действует; в трубку был помещен чистый кислород, а тихий разряд производился при помощи двух впаянных платиновых проволок, + и —, из которых одна была соединена с кондуктором электрической машины, а другая с землей; по изменению давления, определяемому на манометре, можно было судить об уменьшении объема кислорода вследствие озонирования; maximum этого уменьшения не превышал 1/12 начального объема.
Фиг. 1.
Если теперь нагреть эту трубку до 250°, то, по охлаждении, объем находящегося
в ней газа оказывается прежний, какой был до пропускания разряда: нагревание
разрушает О., превращая его снова в кислород, в чем можно убедиться и при помощи
влажной бумажки, покрытой крахмальным клейстером с йодистым калием; такая
бумажка, при соприкосновении с содержащим
О. газом, синеет, потому что
малейшее количество свободного йода дает с крахмалом явственно видимое синее
соединение; но если газ был предварительно пропущен через нагретую пламенем
газовой горелки стеклянную трубку, то никакого изменения в цвете бумажки не
происходит. Можно уничтожить О. в аппарате (фиг. 1) и другим способом, а именно
поместить в нем предварительно ртуть или йодистый калий в запаянной стеклянной
трубочке и разбить ее тогда, когда сокращение объема, вследствие озонирования,
определено; в этом случае О. разрушается без изменения объема. Для полного
уяснения объемных отношений при образовании О., однако, недоставало знания
объема этого газа, образующегося при озонировании и разрушающегося при
нагревании. Соре (1866) определил этот объем, воспользовавшись способностью О.,
которая была открыта Шёнбейном, растворяться в эфирных маслах, терпентинном
(скипидар), коричном и др.; оказалось, что если некоторый объем озонированного
кислорода при нагревании увеличивается на 9,47 куб. см., то при взбалтывании с
маслом такой же объем этого же озонированного кислорода уменьшается на 19,33
куб. см., т. е. на вдвое больший объем — вследствие растворения О. в эфирном
масле, причем остается чистый кислород, который был в смеси с О.; отсюда
следует, что О., превращаясь в кислород, увеличивает свой объем на 1/2,
или что кислород, превращаясь в О., уменьшает свой объем на 1/3:
1) 2O3 = 3O2
и 2) 3O 2 = 2O3.
Таким образом, молекулярный вес О. равен 48, плотность относительно водорода 24;
он должен диффундировать медленнее, например кислорода (плотность = 16) или
углекислоты (плотность = 22), но скорее хлора (плотность = 35,5); по закону
обратной пропорциональности скоростей диффузии с корнями квадратными из
плотностей — 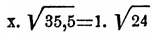 ,
откуда x = 0,8222 —
должно ждать, что во время, потребное для диффузии 1 куб. см. О., может
продиффундировать 0,8222 куб. см. хлора. Соре нашел 0,8376 куб. см. Для
озонирования кислорода (и воздуха) существуют многочисленные приборы, ведущие
свое начало или от озонирующей трубки В. Сименса
(1857), или от озонизатора Бабо. К
первому типу принадлежит наиболее часто применяемый стеклянный озонизатор Бертло
(фиг. 2): трубка d,
запаянная с одного конца, вставляется в более широкую трубку c;
расширение d
пришлифовано к краю c (d
служит пробкой для c);
,
откуда x = 0,8222 —
должно ждать, что во время, потребное для диффузии 1 куб. см. О., может
продиффундировать 0,8222 куб. см. хлора. Соре нашел 0,8376 куб. см. Для
озонирования кислорода (и воздуха) существуют многочисленные приборы, ведущие
свое начало или от озонирующей трубки В. Сименса
(1857), или от озонизатора Бабо. К
первому типу принадлежит наиболее часто применяемый стеклянный озонизатор Бертло
(фиг. 2): трубка d,
запаянная с одного конца, вставляется в более широкую трубку c;
расширение d
пришлифовано к краю c (d
служит пробкой для c);
Фиг. 2.
в кольцеобразное пространство между стенками трубок кислород вводится через трубку b и, подвергшись озонированию, выводится через a к месту назначения; весь прибор помещается в стакан с разведенной серной кислотой, которая вливается и в трубку d; платиновые проволоки, + и —, представляют проводники от вторичной спирали индукционной катушки; тихий разряд совершается через кольцеобразное пространство, по которому проходит кислород, подвергающийся таким образом действию его на значительной площади. Для технических надобностей фирма Сименса и Гальске предложила (1891) аппарат (так называемый Rohrgitter), состоящий из десяти трубок, здесь представлена (фиг. 3) одна из них: это металлическая трубка, большая часть которой занята протекающей, для охлаждения, водой через трубки M и M; озонируемый воздух входит сверху в o и через ряд мелких отверстий попадает в узкое кольцеобразное пространство m, из которого выходит через второй ряд отверстий в нижний конец трубки u, уже с содержанием О.; кольцеобразное пространство m ограничено снаружи концентрической металлической трубкой, более короткой и широкой, кроме того здесь имеется слой слюды, изолирующий обе металлические трубки, которые соединяются с концами вторичной спирали индукционной катушки, для питания которой лучше употреблять переменный ток; 1/2 лошадиной силы с таким аппаратом может дать в 1 секунду 2-3 литра воздуха, содержащего 2-5% по весу О.
Фиг. 3.
В лабораториях пользуются обыкновенно аппаратом Бертло и током от нескольких элементов Грене или обыкновенных вторичных. Аппарат Бабо (фиг. 4) состоит из широкой стеклянной трубки A, внутри которой находится пучок стеклянных трубочек с узким каналом и запаянных с одного конца a; внутри трубочек вставлены платиновые проволочки, наружные концы которых, направленные то направо, то налево, соединены в два проводника, связанные с вторичной катушкой; протекающий по широкой трубке воздух озонируется.
Фиг. 4.
Способность кислорода превращаться в О. под влиянием тихого разряда мало зависит от давления и сильно изменяется с изменением температуры. Вот результаты опытов, произведенных (Готфейль и Шаппюи) с аппаратом Бертло:
|
Давление |
Количество O 2, превращенного в O 3 (% по весу) |
|||
|
760 мм. 380 мм. 300 мм. 225 мм. 180 мм. 87 мм. |
21,4% 20,4% 20,1% 19,1% 18,1% 16,3% |
14,9% 15,2% 15,25% 15,3% 13,7% — |
10,6% 12,5% 11,2% 10,4% 8,9% — |
— 1,17% — 1,18% — — |
|
При темп. |
-23° |
0° |
20° |
100° |
Ввиду такого влияния температуры необходимо охлаждать озонизатор, ради чего аппарат Бертло помещают в объемистый сосуд с ледяной водой, а в других случаях применяют охлаждение текущей водой. Что касается влияния примеси других газов, то хлор вредит процессу превращения кислорода в О., водород относится безучастно, а азот способствует. Наступление предела зависит не от одной температуры, а также от рода электрического воздействия; известен озонизатор (Варрен, 1894), который дает значительно больший процент О. (объем кислорода сокращается на 1/8, что соответствует 37,5% кислорода, превращенного в О.); он состоит из двух или более стеклянных трубок длиной в 6 футов и с диаметром в 1/2 дюйма; трубки соединены при помощи загнутых трубочек и пробок, так что озонируемый газ может проходить последовательно через все трубки; на внутренней поверхности их наклеены квадратики оловянной фольги близко друг к другу, как это делается в "алмазной" лейденской банке (the diamond Leiden jar), внутренние поверхности отдельных трубок последовательно соединены полосками фольги; источником электричества служит сильная индукционная спираль специальной конструкции.
При электролизе разбавленной серной кислоты (на 1 объем кислоты 3 объема воды — Эндрюс) на положительном полюсе, который должен быть золотой или платиновый, а лучше из иридистой платины, выделяется озонированный кислород; содержание в нем О. всегда, малое, достигает 2%, если ванна находится в охладительной смеси. Кислород с примесью О. может быть получен также при действии крепкой серной кислоты на перекись бария, на марганцовокислый калий. Недавно было указано (Брунк, 1893-18 9 5) присутствие О. в кислороде, добываемом обычным путем при нагревании бертолетовой соли, смешанной с перекисью марганца; последняя и является причиной возникновения О., потому что он образуется также при прохождении чистого кислорода над нагретой (до 400 ° и даже выше) перекисью, а при разложении нагреванием чистой бертолетовой соли не образуется; этот факт тем более интересен, что на холоде перекись марганца разлагает О., превращает его в обыкновенный кислород и что О., разлагаемый нагреванием, может, тем не менее, возникнуть при высокой температуре. Возможным объяснением этого явления может служить допущение временного возникновения более богатого кислородом окисла марганца, который нагреванием превращается снова в перекись, а освобожденный кислород оказывается озонированным; подобным образом на кислород действуют сурик и окиси кобальта, никеля, серебра, ртути, золота. При пропускании воздуха через сосуд, содержащий белый фосфор, полупокрытый водой, О. образуется до тех пор, пока поверхность палочек фосфора чиста (Лидс), а потому следует брать разведенную смесь серной кислоты с хромпиком вместо воды; при температурах ниже 6° и выше 38° О. не образуется этим способом; наиболее благоприятна температура в 24°, когда количество О. достигает 0,0025 гр. на литр. Так как в природе происходят многочисленные процессы медленного окисления, то полагают, что этим путем, между прочим, и совершается пополнение количества его в атмосфере. Но озон образуется и при горении в воздухе, в чем можно убедиться (Лёв), направляя быструю струю воздуха в верхнюю часть пламени Бунзеновой горелки в поперечном, относительно пламени, направлении; О. в этом случае можно открыть по его характерному запаху. Запах, а также вкус О. не только характерны, но и достаточны, хотя бы и при очень малых количествах, для его открытия (Кёндалль): запах О. напоминает очень разбавленный хлор; его уподобляют также запаху раков.
Физические свойства О. — газ, обладающий синим цветом, который можно заметить, если смотреть через значительный слой, до 1 метра толщиной, озонированного кислорода. По способности обращаться в жидкое состояние О. близок к углекислоте; но так как он всегда смешан со значительным объемом кислорода, то сжижение его довольно затруднительно. Подвергнув сильному сжатию в аппарате Кальете при сильном охлаждении [Эту операцию должно производить с осторожностью, потому что быстрое сжатие может вызвать повышение температуры газа, и тогда произойдет взрыв: О. превратится в кислород.], причем газ принял индигово-синий цвет, а ртутный мениск сделался стально-синим вследствие окисления, Готфейль и Шаппюи получили капли жидкого О. — после того, как быстро уменьшили давление. Ольшевский произвел сжижение в аппарате Вроблевского, охлаждая кипящим при обыкновенном давлении жидким кислородом. Жидкий О. обладает густым синим цветом; прозрачен в слое, не превышающем 2 мм. толщины; кипит при —106° (при атмосферном давлении) и довольно прочен — не разлагается в запаянной трубке даже при комнатной температуре при соприкосновении с этиленом очень сильно взрывается. О. значительно более кислорода растворим в воде, в 15 раз приблизительно (Mailfert); а именно при 0° в 1 литре растворяется 0,0394 гр., в то время как в 1 литре газа над этим раствором остается 0,0615 гр.; при 60° растворения не происходит (0,0 гр. и 0, 0123 гр.). Водный раствор О. обладает его запахом; при стоянии выделяет неизмененный О. и способен ко всем реакциям, свойственным газообразному О.
Xимuчecкие свойства О. определяются его большой способностью к окислению. Он быстро действует на многие металлоиды и на большую часть металлов; очень чувствительна реакция на ртуть; один пузырек озонированного кислорода, содержащего 2% по объему О., изменяет явственно физические свойства нескольких фунтов ртути, которая теряет тогда свой блеск и начинает прилипать к стеклу; даже серебро окисляется О., покрываясь черным слоем перекиси. Обыкновенно при окислении объем газа не меняется: один атом идет на окисление, а два других образуют частицу обыкновенного кислорода: O 3 + X = O2 + XO.
О. превращается в обыкновенный кислород также при соприкосновении с некоторыми порошкообразными телами, например с перекисью марганца, с платиновой чернью, при встряхивании с размельченным стеклом. В присутствии влажного О. фосфор окисляется в фосфористую кислоту, сернисто-кислые соли в сернокислые, желтая соль в красную, белковые вещества разрушаются, а также и другие органические вещества — каучук, бумага и пр. [Ввиду этого обстоятельства для составления приборов при работе с О. нельзя брать каучуковых пробок, трубок, различных мастик и пр.; приходится пользоваться одним стеклом, спаивая его или пришлифовывая; из жидкостей для запирания О. лучше всего употреблять крепкую серную кислоту, как это делается при устройстве смывания отводной трубки озонизатора Бертло с другой газоотводной трубкой большего диаметра: отводная трубка направлена кверху и конец её окружен еще более широкой трубкой, припаянной внизу к отводной трубке, в образовавшееся таким образом кольцеобразное пространство наливают кислоты и погружают в нее присоединяемую трубку; трубка-муфта может быть укреплена на отводной трубке и при помощи пробки, но тогда в кольцеобразное пространство нужно сначала налить немного ртути, чтобы защитить пробку от кислоты, а затем уже этой последней.]. Аммиак превращается в азотистокислый аммоний, который виден в виде белого дыма, если по каплям вливают нашатырный спирт в сосуд, содержащий О. При прохождении озонированного кислорода через раствор индиго происходит быстрое обесцвечивание, а раствор йодистого калия с примесью крахмального клейстера синеет. Большей, сравнительно с кислородом, способностью к окислению О. обязан той затрате электрической энергии, которая необходима для его возникновения; энергия, которая является скрытой в О., равна, в теплотных единицах на 48 гр. его, 29,6 (Бертло), а по другим опытам (Ван-дер-Мёлен) 36,2 больших калорий [Именно Бертло определил в калориметре теплоту окисления О. мышьяковистой кислоты в мышьяковую — в водном растворе (aq); было найдено: As 2O3.aq + 2O3 = As2O5.aq + 2O2 + 2.68,8 б. к., так как окисление кислородом, непосредственно не происходящее, может быть выражено, на основании опытов Томсена, уравнением: As 2O3.aq + O2 = As2O5.aq + 2.39,2, то теплота разложения О. выразится так: 2O 3 = 3O2 + 2.29,6. Ван-дер-Мёлен определил теплоту разложения О. под влиянием платиновой черни.]. Вопрос о нахождении О. в атмосфере до сих пор считается некоторыми химиками не вполне решенным. Условия для образования его в природе несомненно имеют место — тихий разряд между облаками и землей, процессы медленного окисления (при гниении, при действии воздуха на вещества растительного происхождения, подобные скипидару), испарение воды [Поблизости соляных градирен, вообще в местах, где происходит испарение значительных количеств воды при обыкновенной температуре, всегда замечается (Горуп Безанец) в атмосфере присутствие О. или, быть может, другого окисляющего вещества, например перекиси водорода.]; в присутствие его верят, объясняя некоторые процессы, например беление влажного холста на солнце, засыхание масляной краски, чему способствует прибавление скипидара, и пр. действием образующегося, по мере потребления, О.; но непосредственные определения дают, вообще говоря, не вполне достоверные результаты. Дело в том, что различные способы открытия О. по его способности окислять могут указывать не только на его присутствие, но и на присутствие других окислителей — перекиси водорода, окислов азота и, быть может, иных подобных веществ, еще неизвестных. Особенно трудно отличить О. от перекиси водорода, которая во всех случаях действует сходно с ним, за исключением отношения к металлическому серебру; последнее перекисью водорода не изменяется, а при действии О. покрывается черным слоем окисла. Но эта реакция может открыть только более или менее значительные количества О. и для открытия его в атмосфере не годится, потому что здесь его всегда мало; если даже допустить, что источники образования О. в природе многочисленны, то, конечно, и случаи потребления не менее разнообразны. Перекись водорода в том разведенном состоянии, как она находится в атмосфере, не действует (Шёне) на обыкновенную йодокрахмальную бумажку (нужно смочить ее еще раствором железного купороса), а О. действует и без купороса [Если пропустить воздух, содержащий пар перекиси водорода и О., над хромовым ангидридом, то протекший воздух делается свободным от перекиси водорода, а О. проходит без изменения и, следовательно, может быть открыт йодокрахмальной бумажкой (Энглер и Вильд, 1896 г.).]. Так как при действии О. на йодистый калий образуется едкое кали, то, употребляя среднюю лакмусовую бумажку, смоченную раствором KI (Гузо), можно видеть окрашивание и такой бумажки в синий цвет: окислы азота (и хлор) действуют на KI без возникновения свободной щелочи. Зенгер, пропустив 100 литров воздуха через разбавленную йодисто-водородную кислоту, определил количество свободного йода, которое оказалось соответствующим 0,001 — 0,002 миллиграмма О. Обычный метод сравнительного определения количества атмосферного О. более груб: выставляют на определенное время йодокрахмальную бумажку на воздух (лучше всего в темноте) и сравнивают степени окраски, которую она приняла, с установленной опытом шкалой окрасок; йодокрахмальная бумажка вследствие этого приобрела название — "озонометрическая бумажка". Бумажки, пропитанные закисью таллия, буреющие, вследствие образования окиси, в присутствии О. и неизменяемые окислами азота (Бёттгер), годны только для качественного открытия (Лами). Э. Б. Шёне (1894) воспользовался спектром поглощения О., который состоит из 13 более или менее интенсивных полос, для определения его в воздухе; оказалось, что низшие слои утром содержат меньше О., чем вечером, что в феврале и марте содержание его достигает maximum'a, затем происходит падение до minimum'a, имеющего место в июле, после того идет медленное, до декабря, и затем быстрое возрастание; во время гроз и сильных дождей спектроскоп никогда не открывает О.; высшие слои атмосферы вероятно богаче им (Гартлей, Шёне). В атмосфере больших городов О., как и других подобных окислителей, почти совсем не имеется — здесь слишком велико потребление его для окисления всевозможных веществ, присутствие которых в достаточной мере всегда заметно и отравляет жизнь в городе; вне городов присутствие О. почти всегда может быть открыто, в особенности в морском воздухе, иной раз даже по запаху (см. Озон, санитарное значение). В последнее время озонированный кислород или воздух начинает получать значение и в технике. Здесь, прежде всего, должно указать на беление полотна искусственно полученным О., вместо беления на солнце, причем значительно выигрывается время (7 часов вместо 4 дней); посредством О. очень просто и быстро делают водку "старой", годной к употреблению в качестве таковой, а также для приготовления ликеров; точно также табаку О. придает приятный запах и вкус; обработка О. дерева увеличивает его способность звучать, что применяется при выделке роялей.
С. С. Колотов. Δ .
Озон (сан.). Количество озона в атмосферном воздухе весьма незначительно; по систематическим исследованиям в Париже, оно не превышает, в среднем выводе, 1,4 миллиграмма в 100 куб. м. воздуха, а в частностях подвергается известным колебаниям, о величине и причинах которых, однако, нельзя сказать ничего определенного. Некоторое значение в санитарном отношении имеет тот факт, что в более высоких слоях атмосферы О. встречается больше, чем непосредственно над землей. В густонаселенных местах, а в особенности в больших городах атмосфера содержит меньше О., нежели за городом, и воздух лишается О., если он прогоняется ветром через большой город. Вообще, чем более скучено население, чем грязнее содержатся улицы, площади и дворы, чем больше переходит в воздух дыма, пыли и зловонных испарений, тем больше, конечно, потребление О. и тем меньше его остается в воздухе. В большом количестве О. расходуется на окисление сернистой кислоты, никогда не отсутствующей в воздухе населенных мест, употребляющих минеральное топливо. В замкнутом воздухе жилых помещений почти никогда не находится О. или встречаются только ничтожные следы его; усиленное проветривание несколько увеличивает содержание О., но даже при открытых окнах и дверях О., проникающий в комнату вместе с наружным воздухом, исчезает весьма быстро — он, по-видимому, разрушается от соприкосновения с пылью как плавающей в воздухе, так и осевшей на стенах, мебели и проч.
Санитарное значение озона, при естественных условиях нахождения этого газа в атмосфере, нередко преувеличивается. Его усматривают не только в том, что О. очищает атмосферу от органических примесей и таким образом служит оживляющим элементом для нашего организма вообще, но и в том, что он, будто бы освобождает воздух от возбудителей заразных болезней. Бесспорно, что на берегу моря, в лесу, в горах, в поле, воздух богаче О., нежели в городе, и что О., содействуя очищению атмосферы, может служить прекрасным дезодорирующим средством; но заключить отсюда, что пребывание за городом, в лесах, в горах и проч. обнаруживает на нас благодетельное влияние, именно благодаря О., было бы неправильно уже потому, что для такого действия существующие разницы в содержании О. в воздухе различных мест чересчур незначительны; кроме того, заменяя пребывание в городе деревенской жизнью, мы подвергаемся разнообразным новым влияниям, и притом таким, которые скорее могут иметь решающее значение для нашего здоровья, нежели небольшое увеличение в количестве атмосферного О. Вообще, следует допустить, что физическое благополучие человека едва ли в значительной степени зависит от присутствия О. в окружающем воздухе. Точно также нельзя констатировать никакой более или менее постоянной параллели между колебаниями в количестве атмосферного О. с одной стороны, и появлением или исчезновением каких-либо эпидемических болезней — с другой; это не удается уже потому, что при неудовлетворительности практикуемых способов количественного определения О., и при обычных колебаниях его содержания в атмосфере мы вполне лишены возможности провести надлежащие сравнения между количествами О. во время эпидемий и до появления или после прекращения их. Следовательно, не отрицая санитарного значения атмосферного О. в самом общем смысле, нельзя, однако, допустить предположения о каком-либо специфическом влияния его на ослабление заразных болезней, и потому предложение об оздоровлении воздуха целых городов с помощью искусственного развития О. неосновательно. Целый ряд экспериментальных исследований касался вопроса о применении искусственно развиваемого О. к дезинфекции помещений и вещей при заразных болезнях; но и здесь далеко не оправдались те надежды, которые многими когда-то возлагались на О. в этом отношении. В общем, оказалось, что сухой О. не умерщвляет сухих бактерий; сибиреязвенные бациллы и споры их, бациллы садовой земли, холерные запятые, разные стафилококки, bac. murisepticus и др., будучи подвергаемы действию сухого воздуха с содержанием 4,1 гр. О. в 1 куб. м., нисколько не страдают, ни в отношении своей вирулентности, ни в отношении способности к дальнейшему развитию. Даже в присутствии влаги, такое содержание О. в воздухе не обнаруживает никакого действия на названные микроорганизмы, и лишь при огромной концентрации О. (более 13 гр. в 1 куб. м. воздуха) замечается некоторое влияние его на жизнеспособность упомянутых патогенных бактерий. Гнилостные бактерии, по-видимому, не убиваются не только в сухом, но и в увлажненном виде, при содержании 30 мг. О. на 1 куб м. воздуха, если опыт производится в комнате или в металлическом сосуде; и только в стеклянных банках, т. е. при отсутствии всяких легко окисляющихся предметов, О. действует на эти бактерии даже при сравнительно слабой концентрации. Таким образом О. обнаруживает дезинфицирующее действие лишь при совершенно исключительных условиях, осуществление которых в дезинфекционной практике встретит большие затруднения, и потому применение О. к обезвреживанию помещений, одежды и т. п. предметов должно быть признано неудобным. Находящиеся в воде бактерии убиваются О. лишь в таком случае, если вода не содержит привлекающих О. органических веществ, а потому предложение об употреблении О. для обезвреживания сточных вод едва ли может иметь практическое значение.
Ср. Эрисман, "Курс гигиены" (вып. I, 2-е изд., 1892); Ковальковский, "Zeitschrift f. Hygiene" (IX, стр. 89); Sonntag, "Zeitschrift f. Hygiene" (VIII, стр. 95); Fr ö lich, "Gesundheitsingenieur" (1891, № 16); Ohlm ü ller, "Arbeiten aus dem K. Gesundheitsamte" (VIII, стр. 1); Herman, "Annales de la soc. méd.-chir. de Liè ge" (1892, № 7).
Ф. Эрисман.
|
Page was updated:Tuesday, 11-Sep-2012 18:16:02 MSK |