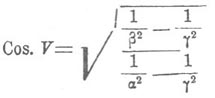
| [ начало ] | [ С ] |
Смеси изоморфные*
— Если раствор, содержащий два или несколько изоморфных между собой веществ, подвергается кристаллизации, то образующиеся при этом кристаллы, будучи вполне однородными, содержат одновременно все изоморфные вещества, бывшие в растворе. Количества веществ, входящих в состав кристаллов, находятся между собой в самых разнообразных отношениях и не зависят от частичных или атомных весов. Такие кристаллы называются С. изоморфными. Состав отличает эти кристаллы от химических соединений, где вещества входят в количествах стехиометрических, т. е. кратных их частичным или атомным весам. Полная однородность — другое необходимое свойство С. изоморфных — отличает их от механических С. Некоторые ученые считают С. изоморфные химическими соединениями неопределенного состава.
Митчерлих, открывший изоморфизм, указал, что изоморфные вещества, будучи сходными по их химическому составу, имеют следующие свойства: 1) подобие кристаллической формы, 2) способность вызывать кристаллизацию одного изоморфного вещества кристаллом другого, т. е. правильное нарастание кристаллов одного вещества на кристалле другого, и 3) наиболее важное и характерное — способность образовать С. изоморфные. Некоторые исследователи, как Копп, а в последнее время Рётгерс, принимают даже, что сущность изоморфизма именно и состоит в образовании С. изоморфных и что нет необходимости, чтобы были в наличности другие свойства. Относительно подобия кристаллической формы указывается, что, с одной стороны, известно много случаев сходства, иногда очень близкого (разницы величин соответствующих углов не превышают нескольких минут), ничего общего с изоморфизмом не имеющего (морфотропия, изогонизм); с другой стороны, имеется много случаев изодиморфизма, где, благодаря нестойкости одной из форм диморфного вещества, обнаруживается изоморфизм между веществами, обычные формы которых очень далеки друг от друга. Наконец, невозможно определить границу, где кончается обуславливающее изоморфизм подобие кристаллических форм, так как у всех изоморфных между собой веществ (кроме, конечно, кристаллизующихся в правильной системе) наблюдаются большие или меньшие разницы в величинах соответствующих углов кристаллов, доходящие иногда до нескольких градусов; например, соль KH 2AsO4 имеет угол пирамиды в 86°34', а изоморфная ей (NН 4)Н 2 AsО 4 90°41'. Вследствие этого некоторые исследователи, напр. Рётгерс, считают достаточным сходство в общем виде кристаллов, не обращая внимания на величины отдельных кристаллографических элементов. Способность вызывать кристаллизацию кристаллом одного вещества в растворе другого — несомненно есть свойство изоморфных веществ (напр. нарастание одних квасцов на кристаллах других). Но обратное заключение, именно, что вещества, способные правильно нарастать друг на друге, изоморфны, является довольно сомнительным, так как известны случаи нарастания веществ, совершенно отличных друг от друга по химическому составу. Такие, напр., нарастания, с постоянной, определенной ориентировкой одних кристаллов на других, образуют: циркон (Zr,Si)O 2 и ксенотин Yt 3P2O8; железный блеск Fe 2O З с рутилом TiO 2, с магнитным железняком Fе 3O4 или с железным колчеданом FeS 2; цианит Al 2SiO5 со ставролитом H 2(Fe,Mg)3Al12Si6O34. Сюда же можно отнести случаи, описанные Ваккернагелем; кристалл борацита Mg 7B16Cl2O30 вызвал кристаллизацию квасцов, азотно-кислый свинец нарастал с образованием параллельных плоскостей на кристалле квасцов, опущенном в раствор первой соли: Франкенгейм указывает, что азотно-кислый натр кристаллизуется из своих растворов на ромбоэдрах кальцита, причем плоскости ромбоэдров NaNO 3 располагаются параллельно плоскостям кальцита. Тем не менее некоторые кристаллографы считают это свойство критерием для признания изоморфизма между данными веществами. Между прочим, Оствальд считает таким критерием способность вызывать кристаллизацию в пересыщенном растворе одного вещества кристаллом другого. Образование С. изоморфных, будучи наиболее важным свойством изоморфных веществ, вместе с тем служит и наиболее надежным средством для определения — имеется ли в данном случае изоморфизм или нет. В некоторых же случаях изодиморфизма, когда одно из видоизменений диморфного вещества крайне нестойко и существование его возможно только при наличности большого количества другого изоморфа — только образованием С. и можно доказать изоморфизм.
Геометрические свойства кристаллов С. изучались мало, и законностей (закономерностей) для зависимости величин углов и осей от состава здесь еще не найдено. Из имеющихся немногочисленных фактов можно указать на следующие. В группе ромбоэдрических углекислых солей кальция, магния, железа и цинка оси смешанных шпатов по величине промежуточны между осями простых, как это видно из прилагаемой таблицы:
| Известковый шпат СаСО 3 | а: с = 1:0,8543 |
| Доломит (Ca,Mg)CO 3 | а: с = 1:0,8322 |
| Магнезит MgCO 3 | а: с = 1:0,8095 |
| Мезитит (Mg,Fe)CO 3 | а: с = 1:0,8129 |
| Железный шпат FeCO 3 | а: с = 1:0,8171 |
| Железоцинковый шпат (Fe,Zn)CO3 | а: с = 1:0,8170 |
| Цинковый шпат ZnCO 3 | а: с = 1:0,8062 |
Но, возможно, что этот случай не относится к С. изрморфным. Именно Рётгерс, основываясь на исследовании удельных весов кальцита, доломита, и магнезита, а также на указании Чермака, что у кальцита форма гемиэдрическая, а у доломита — тетартоэдрическая, приходит к заключению, что нормальный доломит, состава CaMgC 2O6 не С., а двойная соль; остальные же доломиты — изодиморфные смеси кальцита с небольшими количествами MgCO 3 и магнезита с небольшими количествами СаСО 3. Если этот вывод окажется правилен и для других шпатов, то это будет случай морфотропии, а не изоморфизма. Грот исследовал С. хлорно-калиевой и марганцево-калиевой солей. Полученные им результаты, как это видно из нижеследующей таблицы для отношения осей кристаллов, указывают на отсутствие зависимости величин кристаллографических элементов от химического состава.
|
KСlO 4 |
KМnО 4 |
а: с: с |
|
100% |
0% |
0,7819:1:0,6396 |
|
99,7 |
0,3 |
0,7712:1:0,6299 |
|
90,4 |
9,6 |
0,7797:1:0,6408 |
|
82,8 |
17,2 |
0,7839:1:0,6398 |
|
0 |
100 |
0,7974:1:0,6492 |
К таким же результатам привели измерения известь содержащих целестинов, сделанные Ардруни.
Физические свойства С. изучены хорошо и для них, по-видимому, найден общий закон зависимости от состава. Этот закон может быть формулирован так: физические свойства С. аддитивны, т. е. представляют собой сумму соответственных величин свойств компонентов смеси. Иначе говоря, удельные веса, коэффициенты преломления и т. п. С. равны вычисленным по правилу смешения из величин удельных весов, коэффициентов преломления веществ, входящих в состав смеси. Малляр установил этот закон на основании исследований оптических свойств С., Рётгерс распространил его на удельные веса. До настоящего времени нет фактов, противоречащих этому закону, и можно предполагать, что все физические свойства С. подчинятся ему. Результатом аддитивности физических свойств является то, что для ряда смесей, образованных двумя изоморфными веществами, зависимость между величинами физических свойств их и химическим составом может быть выражена уравнением кривой первого, второго или высшего порядка, коэффициенты которого суть функции величин физических свойств двух взятых веществ.
Зависимость удельных весов С. изоморфных от их состава выражается различно, в зависимости от способа расчета: взяв удельные веса и состав в процентах по объему или удельные объемы и состав в весовых процентах, зависимость между ними выразится прямой линией, а если взять удельные веса и выразить состав в процентах по весу или числом частиц одного или другого компонента на 100 частиц смеси, то получится гипербола. Рётгерс доказал аддитивность определениями удельных весов (по способу всплывания) С. солей: K 2SO4 и (NH 4)2SO4, KA12SO4.12Н 2 O и TlAl 2SO4.12H2O, K2SO4.MgSO4.6H2 O и (NH 4)2SO4.MgSO4.6H2O, (NH4)2SO4MgSO4.6H2 O и (NH 4)2SO4.FeSO4.6H2 O. В изодиморфных комбинациях, напр. ромбической MgSO 4.7H2 O и моноклиномерной FeSO 4.7Н 2 O явилось возможным, основываясь на аддитивности, вычислить экстраполированием уд. в. нестойких форм: моноклиномерной MgSO 4.7Н 2 O и ромбической FеSО 4.7H2 O. Укажу, что аддитивность удельных весов С. указывает, что они образуются из своих компонентов без сжатия и без расширения.
Цвет кристаллов С., вероятно, тоже свойство аддитивное. Хотя количественных определений здесь еще нет, но качественно, путем получения смешанных кристаллов различной степени окраски, Рётгерс исследовал изоморфизм щелочных солей в ряду хлорной, йодной, марганцевой, а также в ряду серной, селеновой, хромовой, марганцовистой, вольфрамовой и молибденовой кислот.
Дюфе, изучая С. солей NiSO 4.7H2 O и MgSO 4.7H2O, MgSO4.7H2 O и ZnSO 4.7H2 O, нашел, что коэффициенты преломления С. равны вычисленным по правилу смешения из величин коэффициентов преломления компонентов. Если обозначить через p и р' число молекул одной и другой соли в С., через n и n' их коэффициенты преломления, то коэффициент преломления С.
N = (np + n'p')/(p + p').
Фок нашел то же для смесей серноватисто-кислых стронция и свинца; но его исследования смесей калиевых и таллиевых квасцов, а также смесей серно-кислого и хромо-кислого магния, указавшее на отсутствие зависимости величин коэффициентов преломления от химического состава, заставило его отрицать возможность распространения закона Дюфе на все С. После этого Соре показал, что наблюдение Фока над квасцами неверно: к ним применима вышеуказанная законность, также и к смесям калиевых квасцов с аммонийными; а Дюфе указал, что невозможно получить настолько однородные кристаллы С. MgSO 4 и MgCrO 4, чтобы определение их коэффициентов преломления могло иметь какое-либо значение. Бодлендер подтвердил данные Фока относительно серноватисто-кислых стронция и свинца. Положение и угол оптических осей в кристаллах С. изучались на целом ряде примеров Сенармоном, Вырубовым, Топсое. Работы эти показали, что угол и положение осей непрерывно меняются по мере того, как к одной соли примешиваются все большие количества другой, но пропорциональности между величинами углов осей, например, и химическим составом С. не наблюдается. Такие же результаты получил Шустер, исследуя углы угасания лучей в плагиоклазах, С. альбита и анортита. Малляр, разработав математически теорию преломления света в С., показал, что эти факты не только не противоречат аддитивности оптических свойств С., а наоборот, подтверждают ее. Дело в том, что простая зависимость величин коэффициентов преломления кристаллов С. от химического состава их, выражающаяся уравнением первой степени, ведет к более сложным отношениям между другими оптическими свойствами и составом. Так, для величины угла между оптическими осями V, являющейся довольно сложной функцией всех трех коэффициентов преломления α, β и γ двуосных кристаллов, именно функцией вида:
не может уже быть простой пропорциональности с химическим составом, как это наблюдается для каждого из коэффициентов преломления в отдельности. Положив в основу закон Дюфе, Малляр вывел кривые, выражающие зависимость между величинами углов оптических осей, а также углов угасания лучей и химическим составом С. Результаты его вычислений для смесей, исследованных Вырубовым и Шустером, совпали вполне с экспериментальными данными этих исследователей. Необходимо остановиться здесь на встречающейся иногда оптической аномалии кристаллов правильной системы, по-видимому, связанной с образованием С. Уже Брюстер (Brewster) указал несколько случаев, когда тела, кристаллизованные в правильной системе, обнаруживали двоякое преломление. Био, Марбах, Франкенгейм, Реуш, Клейн, Бен-Зауде (Ben Saude), а в особенности Малляр, Клокке и Браунс занимались исследованием этой аномалии и показали, что такие вещества крайне многочисленны. Франкенгейм первый предположил, что эта аномалия обусловлена примесями. Клокке и Браунс доказали, что все кристаллы с такой аномалией представляют из себя не что иное, как С. изоморфные. Так, в группе квасцов, наилучше в этом отношении изученной, изотропные в чистом виде вещества, по мере увеличения количества изоморфной примеси, становятся все сильнее и сильнее двоякопреломляющими. Например, аммонийно-алюминиевые квасцы, содержащие 1% калийно-алюминиевых, были еще изотропны; при содержании 5% двоякое преломление можно было обнаружить с помощью гипсовой пластинки; при 10% двоякое преломление было видно без вспомогательных средств; при 50% кристаллы между скрещенными николями обнаруживали белый цвет высшего порядка. В других случаях уже ничтожное количество изоморфной примеси обнаруживается настолько сильным двойным преломлением, что получить изотропное вещество представляет некоторые трудности. По этой причине Клокке не мог получить изотропных кристаллов азотно-кислого свинца PbNO 3; получить таковые удалось Браунсу, доказавшему, что двоякое преломление было обусловлено примесью BaNO 3. Получающиеся в этих случаях кристаллы преломляют двояко по всем направлениям. Что касается причины такой аномалии, то относительно нее было высказано несколько гипотез. Био предполагал ее в пластинчатом строении кристаллов; Малляр считает эти кристаллы полисинтетическими, составленными из сросшихся между собой двоякопреломляющих кристаллов систем низшей симметрии. Наконец, Марбах, Клокке, Браунс и др. объясняют эту аномалию существованием внутренних натяжений в кристаллах. В пользу последнего взгляда говорит самопроизвольное растрескивание некоторых С. квасцов, как только кристаллы достигнут некоторой величины, и то, что двоякое преломление этих кристаллов может быть уничтожено внешним давлением. Но вопрос о том, чем обусловлено внутреннее натяжение, остается открытым.
Химический состав С., будучи всегда независимым от стехиометрических отношений образующих С. веществ, зависит от степени изоморфизма между ними. Только при высшей степени изоморфизма, при полнейшей аналогии химической и кристаллографической, два вещества способны образовать полный ряд С. изоморфных, состав которых изменяется от 100% одного компонента до 100% другого. Но такие случаи встречаются сравнительно редко, и гораздо многочисленнее случаи, когда способность образовать С. изоморфные бывает ограничена: получаются С. изоморфные, содержащие избыток одного компонента, и С. изоморфные, содержащие избыток другого; промежуточных С. изоморфных не образуется, подобно тому, как две жидкости ограниченной растворимости дают лишь растворы с преобладанием в составе их или одной, или другой. По более или менее ограниченной способности образовать С. можно составить следующий ряд (Рётгерс):
1) Истинный изоморфизм с полным рядом С. изоморфных. Пример: MgSO 4.7H2 O и ZnSO 4.7H2 O, смешивающиеся во всех отношениях. 2) Истинный изоморфизм с большим или меньшим пробелом в ряду С. Небольшие уклонения кристаллографической формы или частичных объемов обуславливают ограниченную смешиваемость солей: КН 2 PО 4 и (NH 4)H2PO4, BaСl 2.2Н 2 O и SrCl 2.2H2 O. 3) Изодиморфизм с небольшим пробелом в ряде С. изоморфных. Стойкая форма одного компонента образует С. изоморфные с нестойкой формой другого и наоборот. Например: стойкая ромбическая MgSO 4.7H2 O образует с нестойкой ромбической FeSO 4.7H2 O С., содержащие до 18,8% FеSO 4.7H2 O; a стойкая моноклиномерная FeSO 4.7H2 O — с нестойкой моноклиномерной MgSO 4.7H2 O С. до 54,1% MgSO 4.7H2 O. Heстойкие формы, относящиеся к этому случаю, часто можно получить в свободном состоянии. Так, моноклиномерная MgSO 4.7H2 O была получена искусственно, а ромбическая FeSO 4.7H2 O найдена в природе в виде минерала таурисцита. 4) Изодиморфизм с сильно ограниченной способностью образовать С. Получающиеся в этих случаях С. изоморфные содержат иногда такие незначительные количества одного из компонентов, что обнаруживать его приходится микрохимическими реакциями. Пробел в ряде С. изоморфных бывает больше 99%. Нестойкие формы существуют только в С. изоморфных. Сюда, например, относятся некоторые соли калия и натрия: КNO 3 и NaNO 3, КСlO 3 и NaClO 3. 5) Изодиморфизм с незначительной смешиваемостью и с образованием двойной соли. Эти случаи очень многочисленны, и их часто смешивают с истинным изоморфизмом благодаря сходству формы двойной соли с формой одного из компонентов (морфотропия), принимая двойные соли за С., между тем как они отличаются от последних отсутствием аддитивности физических свойств. Примеры: KNO 3 и AgNO 3, K2SO4 и Na 2SO4, CaCO3 и MgCO 3 (в виде шпатов). Каждый из этих пяти случаев может быть изображен очень наглядно графически, если отложить на оси абсцисс химический состав С., а ординатами выразить величины какого-нибудь физического свойства, зависимость между величинами которого и составом С. прямолинейна, например удельного веса, коэффициента преломления. На прилагаемых схемах соответствующих по номерам вышеуказанным случаям, точки в кружках соответствуют определенным химическим соединениям, сплошные линии — существующим С., пунктирные линии служат для интер- и экстраполирования в области несуществующих смесей и нестойких форм.
Фиг. 1. Фиг. 2.
Фиг. 3. Фиг. 4.
Фиг. 5.
Фиг 1 и 2 понятны сами по себе. На фиг. 3 видно, что, экстраполируя, можно определить физические свойства нестойких форм диморфных веществ. На фиг. 4 и 5 такое экстраполирование, конечно, невозможно вследствие ничтожного протяжении сплошных линий. Пунктир служит лишь указанием того, что имеющиеся отрезки принадлежат разным прямым, соответственно диморфизму веществ. В фиг. 5 средняя точка в кружке принадлежит двойной соли.
Е. Бирон.
|
Page was updated:Tuesday, 11-Sep-2012 18:16:33 MSK |