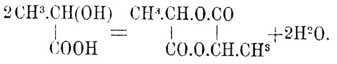
| [ начало ] | [ С ] |
Спиртокислоты
или оксикислоты — вещества, обладающие двумя химическими функциями: как спирты эти соединения заключают в своем составе гидроксильную группу ОН; как органические кислоты — карбоксильную группу СООН. С. можно представить как углеводороды, в которых один или несколько атомов водорода замещены гидроксильными группами и, вместе с тем, один или несколько других атомов водорода замещены карбоксильными группами. Количество карбоксильных групп определяет основность С. Карбоксильная группа сама по себе уже заключает гидроксильную группу. Поэтому атомность С., определяемая количеством гидроксильных групп, всегда больше основности их. Например, СН 2 OН.COOH — С. одноосновная и двухатомная; С 2H2 (ОН) 2 (СООН) 2 — С. двухосновная и четырехатомная и т. д. Номенклатура С., выработанная женевским конгрессом, вовсе не привилась на русском языке (см. Химическая номенклатура). Большая часть С. называется специальными названиями, в зависимости от их способа получения, например: С 2H4 (OH)COOH — молочная кислота; C 2H3(OH)(COOH)2 — яблочная кислота; С 2H2 (ОН) 2 (СООН) 2 — винная кислота и т. д. По более рациональному способу С. называют оксикислотами, т. е. называют кислоту, из которой замещением атома или нескольких атомов водорода гидроксилами производится данная С. и перед названием кислоты прибавляют слово "окси", если один атом водорода замещен гидроксилом, или "диокси", "триокси" и т. д., в случае замещения двумя, тремя и т. д. гидроксилами водородных атомов кислоты; например, молочную кислоту можно назвать оксиуксусной кислотой; винную — диоксиянтарной и т. д. Для обозначения структурных изомеров прибегают к названию углеводородного радикала, с которым соединены гидроксильная и карбоксильная группы, например СН 2 OН.CH 2.COOH называется этиленмолочной кислотой, а СН 3 СНОН.COOH — этилиденмолочной кислотой. Впрочем, для обозначения положения гидроксильной группы в С. гораздо чаще пользуются греческими буквами в алфавитном порядке, обозначая ими атом углерода, у которого находится гидроксильная группа. Углеродный атом, непосредственно связанный с карбоксильной группой, считается первым и обозначается α, второй обозначается β и т. д., например: СН 3 СНОН.COOH будет α-оксипропионовая кислота, СН 2 OН.CH 2COOH — β-оксипропионовая кислота. Количество известных С. в настоящее время необыкновенно велико. Их разделяют на отдельные классы в зависимости от числа гидроксильных и карбоксильных групп и от взаимного расположения этих групп. В истории химии С. были первыми органическими соединениями, на которых выработалось понятие о двойственной химической функции. Лоран и Жерар принимали С. (молочную, салициловую) то за одно-, то за двухосновные. Вюрц установил присутствие в них двух гидроксильных групп. Коль не указал на различие свойств этих водных остатков. H. H. Соколов первый высказал мысль, что один из водных остатков спиртовой, другой кислотный. Кекуле отличил основность и атомность С. и предложил называть их спиртокислотами. Пастеру С. послужили материалом для открытия оптических изомеров (см. Винные кислоты). При развитии понятия об асимметрическом атоме углерода и стереохимических представлений пользовались фактическим материалом, главным образом из области С. (см. Стереохимия). К С. принадлежат важнейшие и более всего распространенные кислоты растений (яблочная, винная, лимонная и др.). К ним также принадлежит большая группа кислот, которые стоят в весьма близком соотношении к группе сахаров, как, например, сахарная кислота и ее изомеры. Эти С. имели громадное значение для выяснения строения сахароподобных веществ, из которых С. могут получаться окислением (см. Глюкозы). Для искусственного получения С. существует очень много методов. Почти все процессы, посредством которых получаются спирты и органические кислоты, могут быть применимы при известном комбинировании их друг с другом для получения С. Наиболее часто употребляются следующие способы получения.
1) Замена галоида гидроксильной группой в галоидозамещенных кислотах, например: CH 2 Cl.COOH + Н 2 O = СН 2 OH.СООН + HCl.
2) Присоединение синильной кислоты к альдегидам и кетонам и затем обмыливание получающихся циангидринов, например:
СН 3 ОСНО + HCN = СН 3 СH(OH)CN;
CH3.CH(OH)CN + 2H2O = CH3.CH(OH)COOH + NH3;
(CH3)2CO + HCN = (CH3)2C(OH)CN;
(CH3)2 C(OH)CN + 2Н 2 O = (СН 3)2.C(OH)СООН + NН 3.
Этим способом хотя и получаются только α-оксикислоты, но значение его громадно, так как реакция протекает правильно и часто употребляется для установления строения С.
3) Окисление многоатомных спиртов или альдегидоспиртов, например CН 2 OН.CH 2 OН + О 2 = СН 2 OН.COOH + H 2 O; сахароподобные вещества CH 2OH.(CHOH)4 CHO при слабом окислении дают С. одноосновные CН 2OH(CHOH)4 CООН, при сильном окислении C. двухосновные COOH.(СHОН) 4 СООН. Некоторые кислоты с третичным водородом при окислении марганцовокислым калием в щелочном растворе дают С., например: (CH 3)2 CH.СООН + O = (СН 3)2 СОН.СООН.
4) Восстановление альдегидокислот и кетонокислот, например: СНО.СООН + H 2 = СН 2 OН.СООН; СН 3 СО.СООН + H 2 = СН 3.СНОН.СООН. Восстановлением ацетоуксусного эфира и его алкилированных производных получаются β-оксикислоты, например:
CH3.CO.CH2.CO.OC2H3 + H2 = CH3CH(OH)CH2.COOC2H5 (эфир β-оксимасляной кислоты).
5) Действие цинка на смесь кетонов или альдегидов с эфирами предельных галоидокислот (С. Реформатский), например:
СН 3 СНО + (СН 3)2 СBr.COOR + Zn = CH 3.CH(O.ZnBr).C(CH3)2 СООR;
CH3.CH(O.ZnBr)C(CH3)2COOR + 2H2O = CH3.CH(OH).C(CH3)2.COOH + ROH + ZnBr(OH).
Химическая натура С. обуславливается присутствием спиртовой гидроксильной и кислотной карбоксильной групп. Как кислоты, С. образуют соли, например CH 2 OH.COONa. Как спирты и как кислоты, С. склонны давать разнообразные типы эфиров, при образовании которых участвует то одна, то другая гидроксильная группа. Для гликолевой кислоты, например, могут образоваться следующие эфиры при комбинировании ее с метиловым спиртом и уксусной кислотой:
1) СН 3O.CH2 CООН
2) СН 3 CО.О.СН 2 СООН
3) СН 2 OН.COOCН 3
4) CH3.O.CH2COOCH3.
Заключая сами в себе элементы спирта и кислоты, спиртокислоты могут самостоятельно давать эфиры с выделением воды без участия постороннего спирта или кислоты. Порядок выделения воды из С. стоит в связи с расположением гидроксильной и карбоксильной групп по отношению друг к другу: α-оксикислоты или α-С. выделяют воду при нагревании и часто даже при обыкновенной температуре в эксикаторе над серной кислотой. При образовании ангидрида или эфира α-С. вода выделяется за счет двух или нескольких частиц α-С., например
Такой эфир носит название лактидного эфира или лактида. β-Оксикислоты или β -C. выделяют воду при нагревании или при кипячении с раствором едкого натра, образуя непредельные кислоты, например: CH 3.CH(OH).CH2.COOH = CH3.CH:CH.COOH + H2O. γ-Оксикислоты, выделяя воду, образуют внутренние эфиры или ангидриды, называемые γ-лактонами (Фиттиг), например:
Склонность к образованию лактонов (см.) у γ-С. очень большая. В водном растворе при обыкновенной температуре они образуются медленно, но при нагревании до кипения — моментально. Из многоосновных γ-C. в этих условиях образуются лактонокислоты, например:
или дилактоны, например:
δ-Оксикислоты или δ-C. выделяют воду в водном растворе при обыкновенной температуре, образуя δ-лактоны, например:
С. действием йодистого водорода восстановляются в кислоты, например, гексаоксигептиловая кислота СН 2OH.(CHOH)5.СООН восстановляется в гептиловую кислоту СН 3.(СН 2)5 СООН. Реакция эта применяется к установлению строения С. При введении гидроксильной группы в кислоту, кислотные свойства соединения увеличиваются. Кислотные свойства С. тем больше, чем ближе расположена гидроксильная группа к карбоксильной.
Отдельные представители С. — см. статьи Гликолевая кислота, Гидракриловая кислота, Молочная кислота, Оксимасляные кислоты, Оксиизомасляная кислота, Глицериновая кислота, Яблочная кислота, Тартроновая кислота, Винные кислоты, Оксиглутаровые кислоты, Лимонная кислота, Сахариновая кислота, Сахароновая кислота, Глюкуроновая кислота, Рицинолевая кислота, Хинная кислота, Пентоновые кислоты, Сахарная кислота, Слизевая кислота, Миндальная кислота, Троповая кислота, Фенилмолочные кислоты. О С., стоящих в близком отношении к сахароподобным веществам, см. также в статьях Арабин и Глюкозы. С., в которых гидроксильная группа помещается в бензольном ядре, см. Фенолокислоты.
К. Красуский. Δ .
|
Page was updated:Tuesday, 11-Sep-2012 18:16:35 MSK |