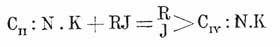
| [ начало ] | [ Ц ] |
Цианистоводородная кислота
(цианистый водород, синильная кислота, формонитрил) — HCN; открыта Шееле в 1782 г. при действии железных опилок и разведенной серной кислоты на раствор цианистой ртути:
Hg(CN)2 + Fe + H2SO4 = 2HCN + FeSO4 + Hg.
Более подробно исследовали ее Бертолле, Пру, Иттнер и, главным образом, Гей-Люссак, который в 1811 г. приготовил безводную Ц. кислоту. В природе Ц. кислота встречается довольно часто в связанном состоянии — в виде амигдалина (см.) C 20H27NO11, которым особенно богаты горькие миндали, листья лавровишни, персиковые и вишневые косточки и проч. Под влиянием воды и фермента эмульсина (см.) амигдалин распадается на бензойный альдегид, мальтозу и Ц. кислоту по равенству:
C20H27NO11 + H2O = C6H5.CHO + C12H22O11 + HCN;
а так как эмульсин обыкновенно сопутствует амигдалину, то указанная реакция происходит уже при настаивании с водой измельченных частей растения. Гресгоф, исследуя сорванные части одного яванского дерева, Pangium edule, нашел в них значительное количество свободной Ц. кислоты: по его расчетам на целое растение приходится ее не менее 350 г. Реакции образования Ц. кислоты весьма многочисленны. Важное теоретическое значение имеет образование ее при сухой перегонке муравьино-аммониевой соли:
HCO.ONH4 = HCN + 2H2O.
Эта реакция позволяет рассматривать Ц. кислоту как нитрил муравьиной кислоты
N ≡ C — H. С другой стороны, мы имеем случай образования Ц. кислоты из аммиака и хлороформа в присутствия щелочи, подобно тому, как изонитрилы (см.) образуются из первичных аминов и хлороформа:
NH3 + СНСl3 + 3КОН = HCN + 3КСl + 3Н2О.
Из других реакций образования Ц. кислоты приведем следующие: непосредственное соединение циана с водородом (см. Циан); действие искр от индукционной катушки на смесь азота с ацетиленом или с другими веществами, способными в этих условиях образовать ацетилен: C2H2 + N2 = 2HCN; разложение метиламина действием красно-калильного жара или при зажигании водного раствора этого вещества; кипячение со щелочами нитробензола, пикриновой кислоты и нек. др. ароматических нитросоединений; окисление многих органических соединений азотной кислотой и др. Для получения Ц. кислоты все эти реакции не применимы. В данном случае обыкновенно исходят из ее солей, простых или двойных, действуя на них кислотами. Чаще всего применяют способ Вёлера, состоящий в перегонке железистосинеродистого калия с разведенной серной кислотой (крепкая H2SO4 дает окись углерода):
2К4Fе(СN)6 + 3H2SO4 = 3K2SO4 + K2Fe2(CN)6 + 6HCN.
В колбу, соединенную с обратно поставленным холодильником, кладут 10 ч. грубо измельченной желтой соли, вливают туда же смесь 7 ч. крепкой серной кислоты с 14 ч. воды и перегоняют, пока кипение жидкости не начнет сопровождаться сильными толчками. Пары Ц. кислоты, выходящие из холодильника, наполненного тепловатой водой, пропускают для осушения через две колонки или U-образные трубки, наполненные кусочками плавленого хлористого кальция и погруженные в теплую воду; наконец, пары сгущают в приемнике, стоящем в охладительной смеси. Для получения этим путем водной Ц. кислоты холодильник ставят прямо, наливают в приемник немного воды и спускают в нее на несколько линий конец форштосса. Уэд, Пэнтинг (Wade, Panthig) употребляют в качестве исходного материала цианистый калий в кусках, действуя на него (по каплям) серной кисл., разведенной наполовину водою. Клэрке рекомендует следующий способ приготовления 3,6%-го водного раствора Ц. кислоты: 9 ч. винной кислоты растворяют в 60 ч. воды; раствор наливают в склянку почти доверху, всыпают сюда 4 ч. цианистого калия, закрывают пробкой, взбалтывают и оставляют стоять, пока не осядет трудно растворимая кислая виннокалиевая соль:
KCN + C4H6O6 = HNC + C4H5KO6.
Для получения Ц. кислоты сухим путем можно употреблять цианистую ртуть или тот же цианистый калий. На первую, по Вокелену, действуют сухим сероводородом при слабом нагревании (30°). Для этого соль помещают в горизонтально положенную стеклянную трубку, передний конец которой наполнен углесвинцовой солью для удержания избытка сероводорода. Когда последняя начинает чернеть, ток газа уменьшают. Происходящая реакция выражается равенством:
Hg(CN)2 + H2S = HgS + 2HCN.
Из цианистого калия Ц. кислота получается действием сухого мышьяковистого водорода (Blythe). Безводная Ц. кислота представляет жидкость с запахом горьких миндалей, кипящую при 26,1°. В охладительной смеси она застывает в кристаллы, плавящиеся при —14° (Готье). По Нефу, абсолютно безводный препарат имеет несколько низшую темп. кип., именно 25,2° и плавления между — 10° и — 12°. При быстром испарении Ц. кислоты потеря тепла столь значительна, что часть жидкости застывает в кристаллы. Уд. в. при 7° = 0,70583, при 18° = 0,6969 (Гей-Люссак). Теплота горения при 18° = 158,620 cal. (Томсен), при постоянном давлении = 159,3 cal. (Бертело); вычисленная отсюда теплота образования = — 23,6 cal.; молекулярное лучепреломление = 10,17 (Канонников). Зажженная Ц. кислота горит фиолетовым пламенем. Постоянство Ц. кислоты находится в тесной зависимости от чистоты ее: примесь влажности или цианистых металлов скоро вызывает побурение жидкости, которая разлагается, выделяя так наз. азульминовую кислоту. Наоборот, следы минеральных кислот сообщают ей большую устойчивость. По Шлундту, диэлектрическая постоянная Ц. кислоты = 95 (для воды 80); след., согласно правилу Томсона и Нернста, ее ионизирующая способность должна быть больше, чем для воды. Это подтверждается опытами Центнершвера, который нашел, что растворы солей в Ц. кислоте проводят ток приблизительно в 4 раза лучше, чем в воде при тех же условиях. Ц. кислота смешивается во всех пропорциях с водой, спиртом, эфиром и, что весьма замечательно, обнаруживает при растворении в воде значительное сжатие, сопровождающееся сильным понижением температуры. Максимум сжатия (94 об. вместо 100) наблюдается при смешении равных объемов Ц. кислоты и воды и отвечает составу раствора 2HCN + 3H2O. Выделить определенный гидрат не удалось (Bussy et Buignet). Ц. кислота принадлежит к числу самых слабых: ее водный раствор едва изменяет цвет синей лакмусовой бумажки и почти не диссоциирован на ионы. Растворы цианистых металлов разлагаются угольной кислотой, отчасти борной и даже фенолом; по определениям Томсена и Бертело, теплота нейтрализации Ц. кислоты едким натром в пять раз меньше, чем для галоидоводородных кислот. Из многочисленных реакций Ц. кислоты отметим следующие наиболее характерные: при кипячении ее с разведенными минеральными кислотами или щелочами образуется муравьиная кислота и аммиак: HCN + 2H2O = HCO.OH + NH3; при "обмыливании" хорошо охлажденной Ц. кислоты дымящей соляной кислотой получается формамид: HCN + H2O = H.CO.NH2; водород в момент выделения восстановляет ее в метиламин: HCN + 2H2 = CH3.NH2; галоидоводородные кислоты образуют кристаллические продукты присоединения, напр., HCN.HCl, 2HCN.3HCl, 2HCN.3НВr, HCN.HJ, легко разлагаемые водою и спиртом; подобно нитрилам, Ц. кислота соединяется с некоторыми хлористыми металлами, напр., 2HCN.SnCl4, 3HCN.SbCl5, 2HCN.FeCl3 и др. Действие галоидов на Ц. кислоту — см. Циан. Из ее соединений с органическими веществами первостепенное значение имеют так наз. циангидрины (см.), образующееся из альдегидов и кетонов. Соли Ц. кислоты (цианистые металлы, цианиды) образуются при насыщении свободной кислоты соответствующими основаниями, путем двойных разложений, восстановлением солей циановой кислоты и другими способами. Щелочные соли служат вместе с желтым синь-кали исходным материалом для получения всех вообще цианистых соединений. Они образуются всякий раз, когда атмосферный азот или аммиак приходят в соприкосновение с раскаленным углем в присутствии щелочи, а также при накаливании со щелочью азотсодержащих органических соединений (см. Цианистый калий и Желтая соль). В воде растворимы только соли щелочных и щелочноземельных металлов и цианистая ртуть. Благодаря происходящему гидролизу, реакция таких растворов щелочная, они пахнут Ц. кисл. и скоро разлагаются с образованием муравьиной кислоты и аммиака. По отношению к высокой темп. постоянны только соли щелочных металлов: остальные при этом разлагаются с выделением циана (см.). Расплавленные соли Ц. кислоты являются энергичными восстановителями, могущими отнимать кислород от металлических окислов, напр.:
KCN + PbO = KCNO + Pb.
В этих же условиях они соединяются с серой. По отношению к кислотам все простые цианистые металлы очень неустойчивы: нагревание с серной или с соляной кислотой нацело разлагает их. Что касается строения Ц. кислоты и ее простых солей, то в этом отношении мы имеем две категории фактов, говорящих в пользу двух возможных формул строения. Вопрос сводится к тому, с чем связан водород или металл соли — с углеродом или азотом. В первом случае будем иметь соединение H — С ≡ ΝIII (Ι), нитрил муравьиной кислоты, а во втором C ≡ NV — Н(II), где водород изонитрильного характера. Приведенные выше способы образования и реакции Ц. кислоты более говорят за формулу (I) (кроме, напр., реакции образования из CHCl3 и NH3, соединений с галоидоводородными кислотами и нек. др.), хотя все они могут быть объяснены и на основании формулы (II). Что касается солей, которые существуют только в одной изомерной форме, то здесь мы имеем явное различие между цианистым калием и цианистым серебром (также ртутью и цинком) по их отношению к йодистым алкилам. В первом случае реакция преимущественно идет в сторону образования нитрилов R.СN, тогда как с цианистым серебром обыкновенно получаются изонитрилы R — N≡C. Важно заметить, что с некоторыми йодюрами цианистое серебро реагирует как Ag—С≡N, т. е. подобно цианистому калию. Неф, считая углерод Ц. кислоты двухатомным, придает ей строение CII≡NIII—H(III) и предполагает возможным двоякое течение реакций между ее солями и йодюрами: возможна, во-первых, непосредственная замена металла углеводородным остатком: CII:NIII.Ag + RJ = С:N.R + AgJ; получающиеся продукты — изонитрилы — заключают, следовательно, двухатомный углерод; во-вторых, возможно сперва присоединение йода и алкила к двухатомному углероду, который переходит в четырехатомный:
и, во вторую фазу реакции, отщепление йодистого металла:
В подтверждение своих взглядов Неф указывает на сильно выраженную у изонитрилов способность к реакциям присоединения, свидетельствующую, по мнению автора, о присутствии в них двухатомного углерода. Цианистый аммоний NH4CN получается сухой перегонкой желтой соли с хлористым аммонием; крист. в кубах; т. кип. 36°. Цианистый натрий NaCN получается пропусканием Ц. кислоты в раствор едкого натра. Кристаллический порошок. Из кипящего 75%-го спирта кристаллизуется с 2H2O, из холодного (над известью) — с одной H2O. Цианистая ртуть Hg(CN)2 (закисная соль неизвестна) получается растворением окиси ртути в Ц. кислоте, причем выделяется очень большое количество тепла (+15,5 cal.). Кристаллизуется в квадратных призмах, растворима в воде, но раствор ее не проводит тока и не дает реакций на Ц. кислоту. Цианистое серебро, AgCN, осаждается из растворов азотносеребряной соли Ц. кислотою в виде белого осадка, похожего на хлористое серебро, но не изменяющегося от действия света. Подобно хлористому серебру, нерастворимо в азотной кислоте, но растворяется в аммиаке. Отличается от хлористого серебра тем, что при кипячении с соляной кислотой выделяет Ц. кислоту. Соли тяжелых металлов, сами по себе не растворимые в воде, чрезвычайно легко образуют растворимые двойные соли с растворимыми цианистыми металлами. С точки зрения теории электролитической диссоциации, этот факт объясняется образованием сложных анионов, напр., Co(CN)6IV, в состав которых входят катионы бывшего в осадке цианистого металла. Вследствие происходящего нарушения концентрации ионов нерастворимой соли последняя переходит в раствор. Таким же образом объясняется растворение в цианистом калии некоторых углекислых солей, окисей и сернистых соединений, а также некоторых металлов, напр., железа, меди, цинка (выделяется водород), тоже ведущее к образованию двойных солей. По своей относительной стойкости рассматриваемые соединения делятся на два класса: одни из них (соли марганца, никеля, цинка, серебра, меди, кадмия) разлагаются уже слабыми кислотами с выделением Ц. кислоты и нерастворимого цианистого металла, напр.:
KAg(CN)2 + HNO3 = AgCN + HCN + KNO3;
K2Ni(CN)4 + 2HCl = Ni(CN)2 + 2HCN + 2KCl;
наоборот, комплексные соли железа (см.), кобальта (см.), хрома и платиновых (см.) металлов представляют чрезвычайно прочные соединения, разлагаемые лишь крепкой серной кислотой или сплавлением с селитрой. Из них особенно важное значение имеют: железисто- и железосинеродистый калий (см. Желтая и Гмелина соль) и берлинская лазурь (см.). В растворах комплексных солей нет ионов металла, входящего в состав сложного аниона: поэтому для открытия такового необходимо сначала разложить комплексные соли.
Качественные реакции на Ц. кислоту и ее соли сводятся к образованию нерастворимых осадков простых или двойных ее солей или же к превращению цианистых соединений в роданистые. Свободная Ц. кислота (можно узнать по запаху) предварительно нейтрализуется щелочью. Характерной простой нерастворимой солью Ц. кислоты является цианистое серебро (см. выше), а из двойных солей — берлинская лазурь (см.). Для образования последней к испытуемому раствору прибавляют сперва избыток едкого кали, потом каких-нибудь солей закиси и окиси железа (напр., железного купороса и хлорного железа) и, наконец, избыток соляной кислоты; образуется синий осадок берлинской лазури. Эта реакция позволяет открыть 1 ч. Ц. кислоты в 50000 ч. воды. Для перевода цианистых соединений в роданистые небольшое количество испытуемого раствора смешивается в чашечке с несколькими каплями едкого натра и с избытком желтого сернистого аммония и выпаривается досуха. Остаток растворяют в воде, фильтруют, если нужно, и, подкислив соляной кислотой, приливают хлорного железа: получается кроваво-красное окрашивание. Последняя реакция — самая чувствительная: она позволяет открыть Ц. кислоту при громадном разведении 1:40000000.
Количественное определение Ц. кислоты весовым путем производится в виде цианистого серебра. Полученный осадок переводят в металлическое серебро, которое взвешивают. Объемное определение состоит в титровании 1/10 нормальным раствором азотносеребряной соли в сильно щелочной среде и в присутствии йодистого калия до появления неисчезающей мути (способ Либиха). На каждый атом серебра приходятся по две молекулы Ц. кислоты:
2KCN + AgNO3 = KAg(CN)2 + KNO3.
Пока в растворе есть свободный цианистый калий, йодистый калий не дает осадка, потому что образующееся йодистое серебро в свою очередь вступает в реакцию:
AgJ + 2KCN = KAg(CN)2 + KJ.
Д. Монастырский. Δ.
|
Page was updated:Tuesday, 11-Sep-2012 18:16:53 MSK |