| [ начало ] | [ Э ] |
Энзимы*
(Enzymen, ungeformte Fermente). — Э. называются органические соединения, в большинстве случаев близкие по составу к белкам, вырабатываемые живой клеткой и обладающие свойствами, будучи выделенными из клетки, вызывать в органических соединениях те же химические процессы, которые происходят в них и под влиянием жизнедеятельности клетки. Э. выделяются как растительными, так и животными клетками. Примером первого рода Э. могут служит диастаз, инвертин и зимаза: диастаз выделяется из солода, образуется в большом количестве при прорастании семян злаков, разлагает крахмал в мальтозу и декстрин; инвертин добывается из дрожжей, превращает тростниковый сахар на d -глюкозу и d- фруктозу; зимаза получается также из дрожжей и вызывает распадение виноградного сахара на спирт и углекислоту. Как пример Э. животного происхождения можно привести пепсин и трипсин; пепсин, выделяемый желудочным соком, превращает белки в пептоны, трипсин, получаемый из панкреатического сока, переводит пептоны в амиды, диамидо-кислоты и аммиак. Основателем учения об Э., если не считать работ Реомюра и Спалацани, еще в XVI в. показавших, что желудочный сок действует точно так же вне организма, как и в организме, следует считать Kirchhoff'a, Dubrunfaut, Payen'a и Possoz'a. Kirchhoff в 1814 г. в мемуаре, опубликованном в "Записках С.-Петербургской Академии Наук", показал, что свежеполученная клейковина обладает способностью при известных условиях превращать крахмал в сахар; Dubrunfant, повторяя его опыты, заметил, что это действие клейковины обусловливается присутствием в ней особого вещества, растворимого в воде, заключающегося в семенах, и что содержание этого вещества при прорастании семян значительно увеличивается; далее он определил наилучшие условия действия его; Payen и Possoz выделили это вещество осаждением спиртом солодовой вытяжки и показали, что полученное твердое тело обладает тем же свойством, как и сама вытяжка, превращать крахмал в мальтозу и декстрин; Payen назвал это вещество диастазом. Получение свободного неорганизованного фермента — Э. — дало толчок к попыткам получения других подобных веществ методом Payen'a, который в результате оказался применимым для добывания почти всех Э.; посредством этого метода были выделены пепсин, трипсин, инвертин и пр. В настоящее время большинство Э. приготовляется тем же методом Payen'a, для каковой цели клетки, в которых предполагается существование Э., убиваются тем или иным способом, затем экстрагируются водой, из раствора Э. выделяется прибавлением спирта и очищается повторными последовательными растворениями и осаждениями. Количество прибавляемого спирта для осаждения того или другого Э. различно: одни выпадают при прибавлении 10—15% спирта, другие 30%, что зависит всецело от растворимости данного Э. в слабых спиртовых растворах. При работе по этому методу нужно избегать оставлять Э. под действием спирта продолжительное время, так как под влиянием спирта большинство Э. утрачивает способность вызывать реакции. Очень часто для осаждения Э. пользуются их способностью выпадать из раствора вместе с образующимся осадком некоторых неорганических соединений, как-то: фосфорно-кальциевой соли, углекислой магнезии, гидрата глинозема и т. п. Э. обладают некоторыми общими свойствами, именно: 1) все они растворимы в воде: числа растворимости характерны для Э.; 2) водные растворы их, будучи нагреты до 100°, утрачивают способность вызывать реакции; 3) в сухом состоянии Э. теряют свои свойства при температуре около 70°; 4) действие всех. Э. зависит от температуры: при повышении температуры до некоторого предела скорость реакции возрастает, при дальнейшем повышении за этот предел начинает падать. Температура наилучшего действия для различных Э. разная и характерна для них; 5) действие Э. приблизительно пропорционально употребленному количеству их. Химический состав Э. точно не определен, так как анализы, произведенные различными исследователями, не дают согласующихся между собой цифр, что указывает на то, что они в чистом состоянии не получаются, что непосредственно вытекает и из самого метода их получения, так как при осаждении спиртом необходимо выпадают вместе с Э. и другие соединения. В общем, состав Э. в большинстве случаев приближается к составу белковых тел. В виду того, что химическим составом отдельные Э. не могут быть охарактеризованы, их классифицируют по их химическому действию. Названия Э. образуются прибавлением суффикса "аза" к корню того вещества, на которое они действуют. По своему химическому действию Э. распадаются на две большие группы; первая заключает Э., которые вызывают распадение более сложной частицы на простейшие, реакций протекает с присоединением воды, это — так назыв. гидролитирующие Э., вторая группа Э. оказывает окисляющее действие на те вещества, с которыми приходит в соприкосновение. Это суть оксидазы. Действие Э. первой группы аналогично гидролизу, вызываемому кислотами при действии на крахмал, сахар.
I. Э. гидратизирующие
A) Действующие на углеводы
| Названия энзимов |
Вещества, на которые действуют |
Продукты действия |
|
Амилаза или диастаз Инвертин или сюкраза. Мальтаза Цитаза Инулиназа Семиназа Пектиназа Мелибиаза Трегалаза Лактаза Корубиназа |
Крахмал. Тростниковый сахар Мальтоза Целлюлоза Инулин Галактан и маннан Пектин, мелитриоза или рафиноза Мелибиоза Трегалоза Лактоза (молочный сахар) Корубин |
Мальтоза и декстрин d -глюкоза и d -фруктоза d -глюкоза Глюкозы Фруктоза Манноза и галактоза Продукты гидратации d -галактоза и d -глюкоза d- глюкоза d -глюкоза и d -галактоза Корубиноза, идентичная с d- маннозой |
B) Энзимы глюкозидов
| Названия энзимов |
Вещества, на которые действуют |
Продукты действия |
|
Амигдалин и другие глюкозиды |
Эмульсин | d -глюкозы
и другой компонент (для амигдалина — горько-миндальное масло и синильная кислота; для арбутина — гидрохинон и т. д.). |
| Гаултераза или бетулаза | Гаултерин | d -глюкоза
и гаултеровое масло (метилсалициловый эфир) |
| Мирозин | Мироново-калиевая соль | d- глюкоза и аллилово-горчичное масло |
| Рамназа | Ксанторамнин | Рамнетин и d -глюкоза |
C) Э. ж и p о в
| Названия энзимов |
Вещества, на которые действуют |
Продукты действия |
| Липаза | Жиры | Жирные кислоты и глицерин |
D) Э. м о ч и
| Названия энзимов |
Вещества, на которые действуют |
Продукты действия |
| Ураза | Мочевина | Углекислый аммоний |
Е) Э. б е л к о в
| Названия энзимов |
Вещества, на которые действуют |
Продукты действия |
|
Энзим сычуга (Labferment) |
Казеин | Параказеин |
| Пепсин | Альбуминоиды | Пептоны и альбумозы |
| Трипсин | Альбуминоиды | Амидо-, диамидокислоты и аммиак |
| Папаин | Альбуминоиды | Амидо-, диамидокислоты и аммиак |
| Пектаза | Пектиновые вещества | Пектиновокислый кальций |
| Тромбаза | Фибриногены | Фибрин |
II. Оксидазы
| Названия энзимов |
Вещества, на которые действуют |
Продукты действия |
| Лакказа |
Ароматические многоатомные фенолы и их производные |
Продукты окисления |
| Оксидин |
Красящее вещество злаков |
Продукты окисления |
| Олеазы | Оливковое масло | Продукты окисления |
| Эноксидаза | Красящее вещество вина | Продукты окисления |
| Тирозиназа | Тирозин | Продукты окисления |
| Зимаза | Глюкоза | Спирт и углекислота |
Несмотря на все разнообразие как самих Э., так и веществ, на которые они действуют, реакции, вызываемые Э., протекают по одним и тем же законам, и почти все одного и того же порядка, при реакции всегда получаются продукты, сумма теплот горения которых меньше, чем исходного вещества. Химическое действие Э. изучено очень хорошо, особенно для Э., производящих гидролиз; для других, как, напр., оксидаз, оно исследовано еще с недостаточной полнотой. Вода как таковая оказывает гидролитическое действие даже при низких температурах, нагревание усиливает действие воды; по опытам Мунка глюкозиды при 150°—160° подвергаются полному гидролизу. Прибавление кислот к воде производит значительное ускорение реакции гидролиза. Э. действуют таким же образом, как кислоты, но оба фактора действуют совершенно различно. Кислоты действуют более или менее одинаково во всех случаях, со всеми соединениями, которые подвергаются гидролизу, каждый же из Э. только с определенными, в этом и заключается важнейшее различие. Реакции ферментов не идут до конца: в конце опыта всегда остается часть нераспавшегося первоначального вещества, как показал Тамман: кажущееся исключение из этого правила представляет Э. сычуга, который нацело превращает казеин в параказеин. Неполнота реакции при действии Э. не есть следствие наступления химического равновесия между двумя противоположными реакциями, разложением под влиянием Э. и новым образованием из продуктов распада исходного вещества, так как Э. возбуждают реакции, идущие только в одном направлении. Предел реакции при Э. наступает вследствие того, что Э. теряют свойство возбуждать реакции, когда концентрация продуктов распада достигнет известной степени; фермент сычуга потому и реагирует до конца, что образовавшийся параказеин нерастворим и выходит из круга реакции. Такое влияние продуктов реакции на ход её доказывается тем, что остановившуюся реакцию можно снова возбудить посредством некоторых факторов, влияющих именно на концентрацию продуктов распада. Остановившееся действие может быть возбуждено: 1) через возвышение температуры; так, напр., если действовать эмульсином на амигдалин при 5°, то через некоторое время реакция прекращается; если же смесь нагреть до 40°, реакция снова возобновляется и опять идет до некоторого предела. Возвышение температуры не должно, однако, доходить до предельной, при которой сам Э. разрушается; 2) через разбавление смеси; 3) через введение нового субстрата в действие, так если в то время, когда реакция между амигдалином и эмульсином достигнет предела, прибавить к смеси салицин, то реакция возобновляется; 4) через прибавление нового количества Э. Действие Э. зависит от количества его в реакции, хотя вообще можно сказать, что малым количеством его можно превратить очень большие количества веществ, так одна часть Э. сычуга свертывает до 400000 частей казеина, одна часть инвертазы превращает до 100000 частей тростникового сахара. Конец таких реакций наступает через очень продолжительное время, продолжительность реакции до наступления предела зависит от количества введенного в нее Э. Влияние количества Э. на скорость изучено для многих из них, как то: для пепсина, птиалина, диастаза, инвертина, эмульсина и многих др. В общем, разными исследователями доказано, что время реакции уменьшается, но не точно обратнопропорционально количеству Э. Тамман показал, что кривая, показывающая скорость действия инвертазы на тростниковый сахар, совершенно отличается от таковой же кривой, полученной для кислот. Для некоторых Э., как, напр., эмульсина, замечено, что при увеличении количества его скорость возрастает только до известного предела, а затем при дальнейших прибавках эмульсина скорость не увеличивается. Концентрация субстрата сильно влияет на начальную скорость, понижая ее в начале так, что в разные промежутки времени в слабых растворах образуется больше продуктов действия Э., чем в концентрированных. Возвышение температуры увеличивает скорость реакции, но опять-таки, как нашел Тамман, не по тому закону, как для кислот: именно он нашел, что инвертаза имеет при 40° ту же начальную скорость, что и при 50 °; температуры выше 50° увеличивают начальную скорость, которая потом сильно падает, что является следствием того, что Э. при высших температурах скоро разрушается, вследствие чего концентрация деятельного Э. в смеси уменьшается. Для объяснения химического действия Э. было предложено много теорий, но все они, хотя более или менее объясняют явление, далеки от полноты и совершенства. Одни авторы пытаются объяснить действие Э. их контактным влиянием, подобным тому, которое оказывает платиновая чернь на некоторые вещества; другие тем, что Э. вступают в химическое взаимодействие с теми телами и образуют непрочное соединение с ними, которое под влиянием воды разлагается так, что Э. делается свободным, а вещество, с которым Э. был в соединении, вступает в реакцию с водой и дает соответствующие данному Э. продукты. Эти две теории наиболее согласуются с фактами. Изложив общие условия, в которых протекают реакции, возбуждаемые Э., прежде чем перейдем к описанию отдельных Э., нужно сказать несколько слов о значении, которое имеют Э. в природе, об их биологической роли. Э. играют большую роль в процессах усвоения питательных веществ организмами, как животными, так и растительными. Большинство питательных веществ поступает в организмы в состоянии, не удобном для усвоения, т. е. для постройки новых тканей. Под влиянием Э. они так изменяются, что становятся легко усвояемыми. Так, крахмал в пище сначала подвергается действию Э. слюны — птиалина, затем Э. панкреатического сока, которые переводят его в мальтозу и виноградный сахар; белки претерпевают также превращение под влиянием Э. желудочного и панкреатического сока. В растениях аналогичные процессы наблюдаются во время прорастания зерен, в которых под влиянием Э. крахмал, клетчатка, белки и жиры, служащие строительным материалом для постройки тканей, для этой цели превращаются в удобоусвояемое состояние; зерна крахмала, что можно наблюдать под микроскопом, при прорастании мало-помалу разжижаются и переходят в глюкозу. Кроме того, Э. переводят потенциальную энергию в кинетическую, так как все реакции, возбуждаемые ими, суть реакции экзотермические, т. е. сопровождающиеся выделением тепла; так, виноградный сахар, разлагаясь на спирт и углекислоту, выделяет 71 ед. тепла, трипалмитин, превращаясь в жирные кислоты и глицерин — 30 ед. тепла, 1 г белков при переходе в мочевину — 4,6. Молекула мочевины при переходе в углекислый аммоний — 8 ед. тепла. Теплота, которая выделяется при реакциях Э., утилизируется организмами для постройки новых тканей из пищи. Переходим к описанию отдельных Э. 1) Диастаз или амилаза, см. 2) Инвертаза (инвертина сюкраза) разлагает (инвертирует) тростниковый сахар на правовращающую d -глюкозу и левовращающую d -фруктозу. Тростниковый сахар вращает вправо, продукты инверсии — влево, так как d -фруктоза имеет больший угол вращения, чем d -глюкоза. Давно был известен тот факт, что при действии дрожжей тростниковый сахар гидратизируется и что гидратация вызывается особым ферментом, который выделяют дрожжи. Бертелло первый выделил этот фермент осаждением дрожжевой вытяжки спиртом. Живая дрожжевая клетка выделяет в раствор очень мало инвертазы, поэтому для приготовления Э. клетку предварительно убивают и затем экстрагируют водой, откуда инвертазу осаждают спиртом. Для того, чтобы убить дрожжи, пользуются хлороформом, эфиром, толуолом или растиранием с мелким песком (E. Fischer). Инвертаза находится почти во всех видах дрожжей, в большинстве случаев вместе с мальтазой, в дрожжах молочного брожения с лактазой, в некоторых редких случаях одна, как, например, в Sacharomyces Mar x ianus. Полученные из различных видов дрожжей инвертазы отличаются своими свойствами, особенно по отношению к посторонним влияниям и температуре оптимума действия, так как инвертаза верхних дрожжей имеет оптимум на 25° выше, чем инвертаза, полученная из дрожжей нижнего брожения, оптимум её действия лежит между 53° и 56°. Сильно разбавленные кислоты содействуют инверсии, более концентрированные понижают ее, а при некоторой концентрации, различной для разных кислот, инвертаза становится совсем неактивной, напр., в присутствии щавелевой кислоты даже в количестве 0,1 грамма на литр сахар не инвертируется. Щелочи действуют очень вредно, как показали опыты Феернбаха, даже в самых незначительных количествах; так, 3,4 куб. см раствора едкого натра концентрации 0,066 г на литр понижают скорость инверсии почти в двенадцать раз. Нейтральные соли в малых количествах усиливают действие инвертазы, в больших ослабляют; количество соли, которое может быть прибавлено, различно для разных солей, поваренная соль и хлористый калий до 0,4% действуют благоприятно, в больших неблагоприятно, а хлористый аммоний может быть прибавлен без вреда в количестве 10%. Хлороформ, эфир уменьшают активные свойства; ядовитые вещества, даже в ничтожных количествах, действуют очень сильно, так, напр. цианистый калий в концентрации 0,02% понижает деятельность инвертазы в шестнадцать, а при 0,04% в 44 раза. 3) Мальтаза — Э., под влиянием которой мальтоза распадается на 2 молекулы глюкозы: C 12H22O11 + H2O = 2C6H12O6. Мальтаза находится как в растительном, так и в животном царстве и всегда сопровождает диастатические ферменты. Важнейший источник получения мальтазы есть солодовая вытяжка, добывается она также из различных видов дрожжей вместе с инвертазой — Sacharomyces octosporus, в животном царстве находится в кишечном соке, найдена и в крови, печени и почках. Для добывания мальтазы солод экстрагируют слабой винной кислотой (0,1:250) и из экстракта осаждают вместе с диастазом спиртом. Для получения из дрожжей, последние сушат и извлекают 0,1%-ым раствором едкого натра, вытяжку осаждают спиртом. Эмиль Фишер показал, что мальтазы разного происхождения обладают различными свойствами, так, напр., мальтаза, полученная из солода, более постоянна по отношению к спирту, чем мальтаза, полученная из дрожжей. Оптимум действий мальтазы лежит ок. 40°, при 50° она утрачивает свои свойства. 4) Цитазы — Э., действующие на клетчатку, найдены в зернах злаков Броуном и Морисом, Ньюкомбом в белом лупине, во многих паразитных грибках, как то в Merulius lacrimans, Peziza, P énici llium glaucum, Polyporus, Agaricus и в пр. Цитазы действуют на клетчатку подобно тому, как диастаз на крахмал, и переводят ее в сахар. Химическое действие их точно не изучено. 5) Инулиназа — Э., превращающий углевод инулин в d- фруктозу, образуется при прорастании клубней, которые заключают инулин как запасное вещество;
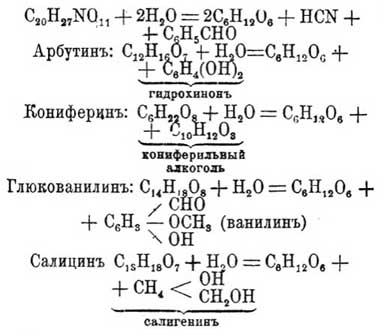
добывается из клубней георгина, артишоков, Helianthus tuberosus и др. семейства Synanthereae. Инулиназа на крахмал не действует. 6) Семиназа — Э., переводящий манногалактан в маннозу и галактозу, найден S. Bourquelot в люцерне. 7) Пектиназа. Э. находится вместе с диастазом в солоде, переводит пектиновые вещества в сахаристые, открыта Bourquelot. 8) Милибиаза — Э., разлагающий мелибиозу на d -галактозу и d -глюкозу, добывается из дрожжей нижнего брожения посредством экстрагирования сухих дрожжей водой, выпадает вместе с инвертазой, которая не действует на мелибиозу. 9) Треалаза. Э. найден в Aspergillus'е и в зеленом солоде, в незначительном количестве в дрожжах, под действием её трегалоза, дисахарид, распадаются на 2 частицы глюкозы. 10) Лактаза. Э., который молочный сахар — лактозу переводит в d -глюкозу и в d -галактозу — С 12 Н 22 О 11 + Н 2 О = 2С 6 Н 12 О 6, находится в дрожжах молочнокислого брожения, в Sacharomyces Kefir, в Saoharomyces Tyrocola, получается осаждением спирта войной вытяжки кефира. По типу своего действия лактаза приближается больше к эмульсину, чем к мальтазе; эмульсин также действует на молочный сахар, а мальтаза вовсе не действует. 11) Корубиназа. Э., найденный в прорастающих семенах Cer atonia siliqua Effî ront'oм, мало исследован, превращает корубин в корубинозу, идентичную по Экенштейну с d -маннозой. 12) Эмульсин, ранее называвшийся синоптазой — Э., разлагающий амигдалин на d -глюкозу, бензалдегид и синильную кислоту. Эмульсин добывается из миндаля, где он сопровождает амигдалин, выделен в 1-й раз Либихом и Вейлером в 1837 г. Кроме миндалей, эмульсин находится в листьях лавровишневых и семенах розоцветных. Кроме амигдалина, эмульсин действует на другие глюкозиды, напр., на арбутин, салицин, конифирин и попурин, на многие экстракты растений, как то: monotropa, polygola, isatis alpina и мн. друг. Эмульсин приготовляется из миндального молока, для чего из последнего осаждают уксусной кислотой белковые вещества и из фильтрата эмульсин осаждают спиртом. Эмульсин представляет белый порошок, хорошо растворимый в воде; раствор его вращает влево. Оптимум действия эмульсина лежит при 45—50°, в растворе при 70° разрушается, в сухом состоянии может быть нагрет до 100°. Щелочи разрушают его, присутствие соляной и других минеральных кислот делает неактивным, равно как уксусная и муравьиная. Большинство нейтральных солей замедляют действие эмульсина; на амигдалин в глицериновом растворе эмульсин не действует. Хлороформ, эфир, тимол делают его недеятельным. Действие других ферментов на эмульсин в полной неизвестно. Танином эмульсин осаждается из раствора. Химическое действие эмульсина выражается в гидратации так: амигдалин распадается по уравнению:
Теоретически особенно интересно, что эмульсин действует на β-глюкозиды, на которые не действуют мальтазы и пр. и не действует на альфа-глюкозиды, на которые действуют Э. дрожжей. Этот факт дал возможность Эмилю Фишеру определять стереоизомерию различных производных углеводов. Действительно, простейшие гексозы (глюкоза, манноза, фруктоза и пр.) со спиртами, особенно с метиловым, в присутствии соляной кислоты образуют соединения, аналогичные естественным глюкозидам, напр., с метиловым спиртом — метилглюкозиды. При этой реакции получается 2 стереоизомера, например, из d -маннозы образуется α-метилманнозит и β-метилманнозит. Если эту смесь подвергнуть действию Э. дрожжей, то α-модификация распадется на сахар и спирт, а β-модификация не изменитея. При действии же эмульсина, наоборот, распадается β-модификация. 13) Гаултераза — есть Э., специфически действующий на глюкозид салицило-метилового эфира; найден в большом числе растений, в которых находятся эти глюкозиды; открыт Шнеегансом в различных видах берез и назван бетулязой. Не действует на салицин и амигдалин, чем отличается от эмульсина. Продуктом действия гаултеразы на глюкозиды является (d -глюкоза и гаултеровое масло. 14) Мирозин — Э., находящийся в некоторых крестоцветных, особенно в семенах черной горчицы, который разлагает глюкозид мироновокислого калия, находящийся в семенах, с образованием аллилово-горчичного масла по уравнению
C10H18KS2O10 = С 6 Н 12O6 + KHSO4 + C3H5N + C + S.
Вода, как видно из формулы, не принимает непосредственного участия в ходе реакции, но последняя происходит только в присутствии её. Мирозин в чистом состоянии не изолирован, действие его аналогично действию других ферментов. 15) Рамназа (рамниназа) получается исключительно из вытяжки семян Ramnus infectoria, открыта Marchall Ward'ом и Dunlop'ом; действует на глюкозид ксанторамнин, находящийся во фруктах, и разлагает его на рамнин и глюкозу, а по Танрэ на рамнинозу и другие еще неизвестные продукты; рамниноза должна быть трисахаридом и распадается на 2 молекулы рамнозы и молекулу галактозы. 16) Липазы. Э., разлагающий жиры на глицерин и свободные кислоты. Давно известно, что жиры распадаются под влиянием сока панкреатической железы и при этом эмульсируются. Клод Бернар первый заметил, что полученная эмульсия окрашивает лакмус в красный цвет, что происходит от образования свободных кислот. Бертело показал, что сок панкреатической железы разлагает искусственно приготовленные эфиры глицерина на глицерин и свободные кислоты. Липазы в свободном состоянии не выделены вследствие того, что они очень непостоянны и легко разрушаются кислотами и даже поваренной солью. Кроме сока панкреатической железы, липаза найдена в крови, почках, печени, в кишках рыб и насекомых. В растениях также найден Э., подобный липазам, выделяющий из растительных масел свободные кислоты при прорастании; так, Green из прорастающих семян Ricinus communis экстрагированием глицерином выделил Э., который при 40° в короткое время выделяет из касторового масла свободные кислоты. Липазы выделены также из низших организмов, как то, из Penicillium, Aspergillus niger и некоторых других грибков. 17) Ураза — Э., найден Musculus'ом в густой, слизистой, аммиачной моче, выделен осаждением спиртом; в сухом состояния постоянен, кислотами и нагреванием разрушается, разлагает мочевину на аммиак и углекислоту, т. е. производит то же, что происходит при мочекислом брожении. 18) Э. сычуга (Labferment, Chymosin, Веnnin) — свертывает молоко, получается из слизистой оболочки желудка, особенно большое количество Э. заключает 4-ый желудок телят. По Блюменталю для приготовления Э. сычуга мелко разрезанный телячий желудок вымачивают в течение 24 часов в 0,5% растворе поваренной соли при 30° Ц. Полученный экстракт подкисляют соляной кислотой до тех пор, чтобы содержание кислоты достигло 0,5%, затем насыщают поваренной солью и оставляют стоять в течение 2—3 дней при температуре 25—30° Ц., часто при этом взбалтывая. Мало-помалу из раствора начинает выделяться белый хлопковатый осадок, который отфильтровывают и сушат при 28° Ц. Полученный белый порошок, видом очень похожий на гидрат глинозема, представляет почти совершенно чистый Э., как доказано Friedburg'ом, Наmmarsten'ом и др., легко растворим вводе, не имеет вкуса и запаха и, будучи прибавлен к молоку в ничтожных количествах, вызывает свертывание. Э. сычуга по Hammarsten ' у имеет следующие характерные химические реакции: 1) не дает ксантопротеиновой реакции, 2) его водные растворы при кипячения не свертываются, 3) не выпадает из раствора при прибавлении спирта, азотной кислоты, таннина, йода, средней уксусно-свинцовой соли, 4) осаждается основной уксусно-свинцовой солью. Наиболее благоприятная температура действия Э. сычуга 40°Ц., при более высокой температуре действие его ослабляется, при 70° совершенно утрачивает свои свойства, хотя в нейтральном растворе при нагревании до 70° в течение очень короткого времени и обнаруживает слабые свертывающие свойства. Присутствие в растворе значительных количеств кислоты или ничтожная щелочность раствора понижают температуру распадения Э. до обыкновенной. Нейтральные соли, напр., поваренная, сернокислая магнезия в концентрациях больших, чем 4%, останавливают действие Э., не разрушая его, в концентрациях до 1% даже ускоряют ход реакции. По опытам Edmunds'a, присутствие в растворе пептона значительно задерживает процесс свертывания молока, так, при 40° Ц. одним и тем же количеством Э. 10 куб. см свертывались без прибавки пептона в 10 минут, с прибавкой 0,625% пептона — в 20 минут, 2,5% пептона — 45 минут, 5% — свертывание через несколько часов. По-видимому, причина действия подобным образом пептонов лежит в том, что они соединяются с кальциевыми солями, при отсутствии которых молоко, как доказано многими исследователями, теряет способность свертываться. Действие Э. сычуга, по Hammarsten'у, заключается в том, что он казеин молока разлагает на два белковых тела, не содержащую фосфора альбумозу и содержащий фосфор параказеин, известковая соль которого и образует сыр. Свертывающая способность Э. сычуга очень велика. Как показал Hammarsten, одна часть фермента может свернуть 800000 раз большее количество казеина. Время свертывания приблизительно обратно пропорционально количеству энзима. Э. сычуга имеет большое практическое значение в сыроварении. Применение его для этой цели см. Сыроварение. Э., свертывающие подобно Э. сычуга молоко, найдены во многих растениях, как то: Galia verum, Drosera, Carica papaya, артишоках, Withania coagulans и мн. др.; Э. последней в Индии, где она произрастает, имеют практическое применение, так как индусы по законам своей религии не могут пользоваться Э. животного происхождения. 19) Пектаза — Э., свертывающий пектиновые вещества, открыта впервые Фреми в соке репы, Bertrand'ом и Маllеvrе'ом найдена во многих растениях, получается обыкновенно, согласно последним авторам, из сока листьев люцерны и клевера осаждением спиртом. Оптимум действия 30° Ц., при кипячении теряет свои свойства, легко растворима в воде, нерастворима в кислотах фруктов. Переводит нейтральные пектиновые вещества в пектиновые кислоты, которые дают нерастворимую известковую соль. 20) Пепсин (см.) 21) Трипсин Э.(см.), Панкреатический сок. 22) Папаин открыт в плодах и млечном соке растений Carica papaya, действие его подобно действию трипсина, т. е. он превращает белки в амиды и амидокислоты, в свободном состоянии выделен из водного экстракта млечного сока спиртом, представляет белковинное тело, растворим в воде с нейтральной реакцией, раствор его не диффундирует, при кипячении мутнеет; в сухом состоянии выдерживает нагревание до 100°, в растворе при 82,5 ° Ц утрачивает свои свойства. Действует очень энергично как в нейтральном растворе, так в слабо кислом и слабо щелочном на белки, продуктами реакции являются пептоны и лейцин, почти не образуется тирозина. На белки живой протоплазмы не действует. Папаин применяется в промышленности для приготовления пептонизированного мяса по методам Сibil'я и A ntweiler'a. Э., подобные папаину, выделены из сока растений Ficus carica и Масrосаrра, ананаса и некоторых друг. Подобный же энзим выделен из листьев насекомоядных растений Drosera rotundifolia и др. В низших растениях также найден Э., способный растворять белки. 23) Трамбаза — так наз. Э., открытый Шмидтом в крови, обусловливающий распадение фибриногена на фибрин и глобулин. 24) Лакказа — открыта Hikorokuro Yoschida в соке Rhus vermicifera (лакового дерева), употребляемом в Японии для лакирования различных изделий, исследована Bertrand'ом. Лакказа относится к оксидазам. Добывается по Bertrand'y следующим образом: сок лакового дерева, в свежем состоянии представляющий прозрачную жидкость, видом и консистенцией похожую на мед, растворяют в большом количестве спирта, при этом часть вещества переходит в раствор; осадок отфильтровывают, промывают спиртом, растворяют в воде, и из раствора осаждают десятикратным объемом спирта; получается хлопковатый осадок, который, будучи высушен в пустоте, похож по виду на гумми, и как оно при гидратации дает смесь галактозы и арабинозы. Этот осадок оказывается деятельным, способным передавать кислород воздуха некоторым другим веществам. Фильтрат гуммиподобного остатка, будучи испарен в пустоте, оставляет маслянистую жидкость лаккол, нерастворимый в воде, но хорошо растворимый в спирте, хлороформе, эфире, бензоле. Дает реакции, соответствующие многоатомным фенолам. Лаккол под влиянием кислорода воздуха приобретает красно-бурое окрашивание и осмоляется; если же подвергнуть его действию кислорода воздуха в присутствии лакказы, окисление идет быстрее, лаккол превращается в черное нерастворимое вещество, которого при отсутствии энзима не образуется. Лакказа действует на целый ряд веществ окисляющим образом; так, гидрохинон переводит в хинон.
Иногда реакции лакказы сопровождаются выделением углекислоты. Все вещества, на которые действует лакказа, относятся к ароматическому ряду, заключают в себе, по крайней мере, 2 группы водного или амидного остатка, находящихся в пара- или орто-положениях и почти совсем не действует на мета-соединения; так, напр., гидрохинон (пара-дифенол), пирокатехин (ортодифенол) и резорсин (метадифенол) при часовом стоянии в смеси с лакказой абсорбируют следующее количество кислорода:
Гидрохинон поглотил 32 куб. см O; выделил 1,7 СО 2
Пирокатехин " 17,4 " " " " 2,8 "
Резорсин " 0,6 " " О.
Бертран нашел лакказы во многих высших растениях, а также в некоторых грибках; реакцией на присутствие лакказы, по Бертрану, служит окрашивание спиртового раствора гваякола. 25) Оксидин — Э., вызывающий появление темного цвета у черного хлеба, открыт Бугру в отрубях, получается экстрагированием последних в атмосфере угольной кислоты последующим осаждением спирта. Оксидин действует подобно лакказе, пeреводит гидрохинон в хинон. 26) Олеаза — Если свежие оливки оставить в куче, то они легко приходят в брожение, причем температура возвышается, выделяется углекислота, уксусная кислота и жирные кислоты. Talomei доказал, что это брожение вызывается энзимом, который он назвал олеазой и выделил ее из оливкового масла, промывая последнее водой, в которой растворяется энзим. Олеаза вызывает при доступе воздуха в оливковом масле, во-первых, образование свободных жирных кислот, которые придают маслу прогорклый вкус, во-вторых, выпадение красящего вещества масла. Оптимум действия олеазы лежит около 38°. Растворы кислот понижают действие её, так что можно думать, что разложение масла под влиянием её не будет глубоким, так как свободные кислоты уничтожат окислительную способность олеазы. 27) Эноксидаза — открыта Cazenenve'ым, вызывает обесцвечивание виноградного вина вследствие окисления красящего вещества. Эноксидаза, по мнению одних ученых, находится в самом винограде, других, — выделяется грибками. Для получения эноксидазы вино осаждают избытком спирта, в осадок выпадает камедеподобное вещество, в котором заключается и энзим, осадок очищается повторными растворениями в воде и осаждениями спиртом. Очищенный таким образом осадок растворяется в воде, образуя бесцветную, слегка опалесцирующую жидкость. Окисление красящего начала вина происходит на счет кислорода воздуха. Laborde подтвердил это прямыми опытами: при окислении происходит выделение углекислоты. Эноксидаза действует на французские и итальянские вина, но не действует на турецкие и испанские. Наиблагоприятная температура для действия эноксидазы 35°, около 80° она разрушается, при 60° энзим становится мало деятельным. Температурные условия деятельности энзима изучены хорошо в виду их значения для практики виноделия. Сернистая кислота в дозах от 0,01 до 0,08 в литре задерживает действие эноксидазы. Подобным образом действует спирт в растворах свыше 9% 28) Зимаза. Бюхнер в 1897 г. выделил из дрожжевых клеток сильным давлением очень активную жидкость, которая способна превращать сахар в спирт и углекислоту, подобно самим дрожжам. Действующее начало этой жидкости он назвал зимазой. Для приготовления зимазы, по Бюхнеру, употребляется следующий метод: дрожжи смешивают с кварцевым песком, инфузорной землей и небольшим количеством воды, растирают, затем подвергают давлению под гидравлическим прессом, возвышая постепенно давлением с 4 до 500 атмосфер. При этом получают опалесцирующую, богатую белками жидкость, которую фильтруют через Шамберлендовский фильтр и сушат при 35°. Из килогр. дрожжей получается около 500 куб. см жидкости, в которой растворено от 5 до 7% твердого вещества, заключающего в себе и энзим — зимазу. Зимаза очень непостоянна: в растворе при доступе воздуха или при нагревании до 40—50° она утрачивает свои активные свойства, при сохранении же без воздуха или в концентрированном сахарном растворе долее удерживает их; в сухом состоянии может быть нагрета до 100° без всякого влияния на способность вызывать реакции. Хлороформ, бензол, толуол приостанавливают реакцию зимазы. Она разлагает перекись водорода; другими ферментами очень легко разрушается. Зимаза вызывает алкогольное брожение, разлагает сахарозу, d-глюкозу и мальтозу на спирт и углекислоту C 6 Н 12 О 6 = 2СО 2 + 2С 2 Н 5 ОН.
Н. Тутурин Δ.
|
Page was updated:Tuesday, 11-Sep-2012 18:17:02 MSK |