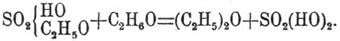
| [ начало ] | [ Э ] |
Эфир серный
или этиловый. — Одноатомные спирты, теряя воду, способны давать производные двух родов: 1) углеводороды, 2) окиси углеводородных радикалов; к числу последних принадлежит и обыкновенный или так называемый серный эфир, который, как окись этила (C 2H5)2O, отвечает этилену — углеводороду, производимому из обыкновенного спирта:
С 2 Н 6 О — Н 2 О = С 2H4
2С 2 Н 6 О — Н 2 О = (С 2H5)2 О.
Этот Э. играет большую роль в лабораторной и заводской технике, благодаря своей способности растворять многие тела весьма различного химического характера, сопровождаемой, кроме того, летучестью. Применение Э. к фабрикации взрывчатых веществ определило место его в промышленности и вызвало крупное производство этого продукта, ввиду чего изложение свойств его представляет двойной интерес: общенаучный и практический. Э. (окись этила) при обыкновенной температуре есть очень легкая, подвижная и летучая жидкость, прозрачная, с приятным запахом, если продукт чист; химически чистый Э. почти не встречается в продаже, так как трудно отделяется от последних следов влаги; такой чистый Э. кипит при 34,9° Ц. и не замерзает даже при охлаждении до —100° Ц.; его удельный вес около 0,719 при 15° Ц., но есть фабрики, которые, приготовляя чистый продукт перегонкой его над металлическим натрием, давали Э. удельного веса 0,717; Э., перегнанный над хлористым кальцием, имеет удельный вес 0,720, а оставаясь на воздухе, быстро поглощает влагу и приобретает удельный вес в 0,721—0,722. Изменение удельного веса Э. с температурой хорошо выражается формулой:
St = 0,736 [1 — 00,0154t].
По этой формуле S15° = 0,719, а S0° = 0,736, что удовлетворительно согласуется с опытом. Большая упругость паров Э. (например, при 100° Ц. она превосходит 6 1/2 атмосфер) и сравнительно малая теплоёмкость его (около 0,53) и теплота испарения (90,5) были причиной того, что Э. предлагали в замене воды для паровых машин, как жидкость, требующую менее топлива для исполнения той же механической работы, какую исполняют водяные пары, но его летучесть (потери) и огнеопасность, в связи со значительной стоимостью, послужили главным препятствием к осуществлению этого предложения. Изменение упругости паров Э. с температурой было изучено Реньо и в последнее время Рамзаем, и числа обоих исследователей достаточно близки между собой. По Реньо, в миллиметрах ртутного столба:
| —20° | 68,90 |
| 0° | 184,39 |
| +20° | 432,78 |
| +40° | 907,04 |
| +60° | 1725,01 |
| +80° | 3022,79 |
| +100° | 4953,30 |
| +120° | 7719,20 |
Температура абсолютного кипения (критическая температура) Э. равна 194° и давление, ей отвечающее, есть 36 At, т. е. 27360 мм ртути; понятно, что такая температура легко достижима, если бы это понадобилось, даже в большом виде, для целей техники. Способность Э. быстро испаряться служит для получения низких температур: так, в смеси с твердой углекислотой достигается температура — 77°. Э. — один из лучших растворителей не только многих органических веществ, богатых углеродом (жиры, резина), но и неорганических (галоидные соли, вроде сулемы, хлористого железа, хлорного золота; йод, а также бром, фосфор, сера и др.); со спиртом он смешивается во всех пропорциях, воду растворяет в количестве 2,7 грамм на 100 грамм Э. при 10—20° Ц.; в воде он растворим больше, чем вода в нем, а именно 100 частей воды растворяют 9,6 частей Э. при 10° Ц. и 7,5 при 20° Ц.; таким образом при смешении Э. с водой имеется два слоя, каждый из которых есть насыщенный раствор одной из жидкостей в другой. В этом случае (т. е. при двух слоях насыщенных растворов), по Д. П. Коновалову, упругость пара обоих слоев одинакова и равна 431 мм ртути при 19,8°. Выше было указано, что по элементарному составу Э. отличается от спирта элементами воды, а так как, кроме того, он и получается действием серной кислоты на спирт, то прежде объясняли образование Э. прямым обезвоживающим действием реагентов (H 2SO4, HCl и др.) и Э. рассматривался как ангидрид спирта, промежуточный между гидратом (C 2H6 O) и полным ангидридом (С 2H4), согласно чему, например, Дюма представлял Э. и спирт как водные соединения 2С 2H4.Н 2 О и С 2H 4.Н 2 О. Так как такие взгляды плохо согласовались с фактом получения огромных количеств Э. при сравнительно незначительном расходе кислоты, то прибегли к объяснению на основе понятия о каталитическом действии (Митчерлих, Берцелиус); ныне принимаемое объяснение реакции образования Э. принадлежит Вильямсону, оно вытекает из следующих соображений: 1) обезвоживающее действие серной кислоты не может иметь места уже потому, что при реакции образования Э. (из спирта и серной кислоты при 140° Ц.) этот последний отгоняется вместе с водой и одно и то же количество кислоты производит столько Э. и воды, что эта последняя могла бы уничтожить всякое обезвоживающее действие кислоты, если бы реакция зависела от этого последнего свойства; 2) опыт показывает (опыт Reynoso), что при 200° Ц. в закрытом сосуде можно превратить в Э. большое количество спирта действием незначительного количества разведенной соляной кислоты, тогда как при 100° даже с избытком HCl Э. не получается, а образуется только хлористый этил.
Из сопоставления всех обстоятельств реакции образования Э. Вильямсон пришел к заключению, что она совершается в двух фазах: сначала из спирта и серной кислоты образуется этилсерная кислота:
С 2H5HO + SO2(HO) = SO2 (НО)(С 2H5 О) + Н 2 О,
а затем эта последняя со второй частицей спирта образует Э. и серную кислоту, которая таким образом как бы не изменяется при реакции
Эта теория подтверждается тем, что обе эти фазы производства Э. — обе реакции могут быть воспроизведены отдельно, т. е. независимо одна от другой. По этой схеме опыты Reynoso объясняются аналогично: сначала образуется хлористое производное
HCl + C2H5(HO) + Aq = C2H5Cl + H2O + Aq,
а затем со второй частицей спирта — Э.
C2H5Cl + C2H5(HO) + Aq = = (C2H 5)2O + HCl.Aq.
Но так как в зависимости от температуры может идти и обратная реакция, т. е. С 2H5 Cl + Н 2 О = С 2H5 (НО) + HCl, то очевидно, что весь вопрос производства Э. сводится к выбору определенных условий реакции и в особенности температуры. В пояснение этого можно указать, что, например, при 170—200° и при избытке серной кислоты Э. почти не образуется, потому что тогда весь почти спирт сразу перейдет в этилсерную кислоту, и так как за отсутствием спирта Э. не может образоваться и температура высока, то происходит сухая перегонка этилсерной кислоты с образованием этилена SO 4HC2H5 = H2SO4 + C2H4. Образование Э. действием хлористых металлов на спирт также сводится к той же схеме: а именно хлористый металл разлагается в прикосновении с алкоголем и дает (хотя бы и в небольшом количестве) водную окись металла и хлоропродукт спирта, последний же, действуя в свою очередь на спирт, дает Э. и соляную кислоту, которая и переводит вновь окись металла в хлористое соединение, замыкая, так сказать, цепь реакций. Кроме хлористых, сернокислые соли также способны давать Э. в аналогичных условиях, но не все металлы с одинаковой легкостью дают эту реакцию; так, хлористые марганец, кобальт, никель, кадмий, железо, цинк дают Э. гораздо более, чем хлористые же ртуть и медь; из сернокислых солей — уран дает много Э., а другие металлы (Zn, Fe, Cd...) гораздо менее. Сернокислый глинозем при 200° Ц. почти вполне превращает алкоголь в Э. без образования газов (С 2 Н 4), при 240° газы выделяются непрерывно. Реакция образования Э., установившая его строение, как этилового спирта, в котором водород водяного остатка замещен этилом, была указана Вильямсоном:
C2H5I + C2H5NaO = C2H5OC2H5 + NaI,
т. е. действие йодистого этила на этилат натрия; известна и обратная реакция: Э. при действии HI (Э. насыщают HI при 0°) дает воду и йодистый этил:
(C2H5)2O + 2HI = H2O + 2C2H5I.
Замечательна способность Э. давать кристаллические соединения (частица на частицу) со следующими солями: SbCl 2, SbBr3, ВiВr 3, HgBr2, AlBr3, TiCl4, SnCl4, SnBr4, VdOCl3; также 2 частицы Э. на частицу соли: SbBr 3, ВСl 3 и три частицы соли на две частицы Э., например 3РСl 5.2(С 2H5)2 О; сюда же надо отнести и кристаллическое соединение Э. и воды С 4 Н 10 O.2Н 2 О, образующееся при охлаждении до —35,5° Ц. Замечательна еще реакция обратная образованию Э.: при 160° с водой и небольшим количеством серной кислоты Э. дает спирт, вероятно, переходя тоже через сульфовинную кислоту:
(С 2H5)2 О + 2H 2SO4 = Н 2 O + 2С 2H5 НSO 4,
которая разлагается водой на спирт и серную кислоту; последняя вновь
действует на Э. и таким образом идет непрерывное разложение Э., аналогичное
непрерывному его образованию при температурах более низких. Из продуктов
замещения следует отметить хлоропроизводные Э.; при прямом действии хлора на
охлажденный Э., в рассеянном свете, получаются моно- и двухлорэфир; первый из
них одинаков с продуктом действия соляной кислоты на спиртовой раствор альдегида
(Вюрц и Фраполи) C 2H4ClO.C2H5;
он представляет жидкость, кипящую при 97—98° Ц., которая может быть
рассматриваема как этилированный хлоргидрин гликоля
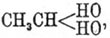 , который так
же способен к реакциям с усложнением частицы (уплотнением), как и обыкновенный
этиленгликоль. Так, действием воды на монохлорэфир получается соляная кислота и
ряд продуктов, из которых известнейшие суть C 2H5O—C2H4 —OH
(жидкость, кипит при 50°) и C 2H5O—C2H4—O—C2H4—OC2H5
(кипит при 80—84°).
, который так
же способен к реакциям с усложнением частицы (уплотнением), как и обыкновенный
этиленгликоль. Так, действием воды на монохлорэфир получается соляная кислота и
ряд продуктов, из которых известнейшие суть C 2H5O—C2H4 —OH
(жидкость, кипит при 50°) и C 2H5O—C2H4—O—C2H4—OC2H5
(кипит при 80—84°).
Двухлорэфир CH2Cl.CH2Cl.OC2H5. Представляет бесцветную жидкость с запахом соляной кислоты, кипящую при 140—145°, удельного веса 1,174. Действием воды она дает: CH 2Cl.CH(OH)—OC2H5 (кипит при 95—96°) и продукт уплотнения CH 2Cl.CH(OC2H5)—O—CH(OC2H5).CH2 Cl (кипит при 165°).
Трихлорэфир (кипит при 167—168°) получается действием пятихлористого фосфора на двухлорацеталь:
CHCl2CH(OC2H5)2 + PCl2 = CHCl2.CHCl.OC2H5 + PCl3O + C2H5Cl.
Тетрахлорэфир (кипит при 189,7°) может быть получен из алкоголята хлорала тоже действием пятихлористого фосфора:
CCl3CH(OH)—OC2H5 + PCl5 = PCl3O + HCl + CCl3.CHCl.OC2H5
Вода разлагает его на хлорал, спирт и соляную кислоту.
Пентахлорэфир C2Cl5OC2H5. Жидкость удельного веса 1,645, бесцветная, густая, представляющая окончательный продукт действия хлора на Э., в отсутствии света закипает при 119—210°; не перегоняется без разложения.
Перхлорэфир C4Cl10 O. Твердое тело, плавится при 69°, кристаллизуется в чешуйках; получается при действии сухого хлора на безводный Э., при последовательном действии прямого и рассеянного света; в этих условиях он сопровождается шестихлористым углеродом, как продуктом разложения: С 4 Сl 10 O = С 2 Сl 6 + ССl 3 СОСl.
Э. был известен уже в XIII столетии (Raimund Lullius); им занимался Валериус Кордус, по работам которого составлено было в XVI столетии описание Э. Гесснером под именем Oleum vitrioli dulce. Э. был известен еще Парацельсу, а в 1730 г. Фробениус работал над его исследованием; тем не менее только в 1800 г., благодаря Розе, стало известно, что в состав Э. не входит сера, как это до него предполагали. В настоящее время Э. готовится как в больших количествах (на заводах), так и в малых (в лабораториях) одним и тем же способом Вильямсона. В лабораториях нагревают до 140° смесь из пяти частей алкоголя (90 %) и 9 частей крепкой серной кислоты; поддерживая по возможности эту температуру, приливают дальнейшее количество спирта непрерывной струёй, наблюдая, чтобы термометр не падал ниже 130° и не поднимался выше 140°. В дистилляте получается сырой Э. — смесь из Э., спирта и воды, который затем подвергается ректификации. Реакция ведется в чугунной или стеклянной реторте с холодильником. Полученная смесь при ректификации делится на порции, кипящие при 35°, 35—80° и 80—100°. Первая есть Э., вторая — смесь спирта с Э. (идущая в ректификацию с новой порцией сырого Э.) и третья — слабый спирт, который идет в отдельную переработку для извлечения алкоголя. По достижении температуры 100° перегонка сырого Э. прекращается.
Заводское приготовление эфира. Для приготовления Э. поступает так называемый сырой спирт винокуренных заводов, идущий непосредственно с перегонных аппаратов, следовательно, со всеми примесями, образующими сивушное масло, как-то: пропиловый, бутиловый и амиловый спирты, уксуснокислый Э., ацетальдегид и т. д. По общим приемам составляется для всех бочек средняя проба, которая и испытывается химически (на сивушное масло, на кислотность и др.) и на содержание чистого спирта металлическим спиртомером при температуре 12 4/9° P. Затем определяют общее число градусов принятого спирта (по количеству в ведрах, по крепости, определенной выше, и по температуре), пользуясь таблицами, прилагаемыми к спиртомеру; при этом спирт перекачивают через особые мерники — баки (железные, чаще всего) на 40—60 ведер, хорошо выверенные и снабженные шкалой с делениями в 1/10 ведра, нанесенными на стекле (лучше врезывать такое стекло в самые стенки бака). Принятый спирт должен содержать менее 3/4 % сивушных масел, количество которых определяется по одному из способов Кучерова, Саваля и Резе; количество этих примесей влияет на расход кислоты (реакция с сивушным маслом) и щелочи (нейтрализация SO 2, являющейся при предыдущей реакции), служит причиной образования смол при реакции, а потому принято брать возможно крепкий спирт не ниже 90° по Траллесу. Через мерники спирт попадает в особые баки из листового железа, назначаемые для хранения спирта (емкостью, например, в 2000 ведер и более), расположенные на высоких постаментах, дающих возможность осматривать дно (на случай течи); баки эти также снабжены стеклами и шкалами для учета спирта и помещаются в отдельном здании. Число и емкость их таковы, чтобы можно было сразу запасаться спиртом на продолжительный срок при полном ходе завода. Из этого запаса спирт насосом, по мере надобности, подается на завод для переработки; здесь он принимается в один общий для всего завода бак, имеющий емкость, равную суточному расходу спирта [Таково устройство одного из действующих в России заводов.], и отсюда уже направляется в так называемые распределители, откуда идет в этерификаторы. Каждому прибору, производящему Э. (этерификатору), отвечает свой распределитель, представляющий собой бак, уровень спирта в котором виден постоянно по положению стрелки на шкале, отвечающей каждому такому распределителю. Шкала со стрелкой находится у самого этерификатора, так же как и кран, регулирующий приток спирта. Величина распределителя бывает около 150 ведер ёмкости, а число их зависит от размеров производства. При 4-х распределителях (а следовательно, и этерификаторах) завод имеет уже солидные размеры, перерабатывая около 700 ведер спирта и получая около 300 пудов Э. ежедневно.
Этерификатор. Приборы, в которых происходит реакция образования Э., могут быть либо в виде реторты, либо иметь форму вроде вертикального закрытого котла и тогда носят название этерификаторов. Они бывают различных типов как по материалу (медь, железо, опаянное свинцом), так и по величине. Железный этерификатор имеет внутри одну или две, что лучше, свинцовые оболочки на случай порчи одной из них (внутренней) во время реакции; толщина свинца 9—10 мм (ординарная оболочка) или 5 мм (двойная оболочка). Этерификатор нагревается паром, идущим по змеевику, положенному на дне или проведенному винтообразно по внутренней поверхности стенок этерификатора; пар глухой, т. е. не выходящий в реагирующую массу, а уже в виде воды выбрасываемый из другого конца змеевика через конденсационный горшок. Общая длина змеевика 50 м при размерах этерификатора (внутренних) d = 1,8 м, h = 1,77 м. Как паровая труба, так и все нижеописанные проходят через крышку этерификатора, которая для легкости делается медной (не опаяна свинцом). Спирт вводится двумя трубами на дно этерификатора; термометр (пружинный) помещается в глухой трубке, наполненной маслом; поплавок (стержень его) движется также в глухой (стеклянной) трубке. Трубки, ведущие спирт, снабжены воздушными кранами (для выпуска спиртовых паров, если они накопятся) и гидравлическим запором, мешающим перебросу смеси в распределители. Для наблюдения за притоком спирта устроены стеклянные фонари, сидящие на самой трубке, ведущей спирт, в которых видно, с какой скоростью идет спиртовая струя; эти фонари служат для регулирования притока в зависимости от обстоятельств хода аппарата; весь этерификатор устанавливается на чугунных кольцах, так что его выпуклое дно легко доступно для осмотра. Пары образовавшегося Э. отводятся особой трубкой в так называемый нейтрализатор, где они промываются щелочью, о чем сказано ниже; теперь же опишем ведение дела при пуске в ход этерификатора. Сначала вливают серную кислоту удельного веса 1,834, затем по трубам пускают почти равный объем 90-градусного спирта, так что на 5 частей спирта по весу придется 9 частей купоросного масла и будет заполнено около 2/3 объема этерификатора; по мере приливания спирта смесь нагревается вследствие образования этилсерной кислоты и доходит до температуры в 70°; когда весь спирт влит, начинают нагревание смеси, пропуская пар в 2 1/2 — 3 атмосферы по змеевику, и доводят температуру до 125° Ц.; начинает отгоняться Э., и тогда вновь пускают спирт так, чтобы объем смеси в этерификаторе не изменялся, с этого момента устанавливается непрерывный ход этерификатора. Температура должна оставаться в пределах 125—135°, струя Э. должна иметь плотность 0,790—0,800 (но ближе к 0,800) и тогда ход работы считается нормальным; то и другое регулируется притоком спирта и количеством пара. По мере хода этерификатора смесь, его наполняющая, медленно, но непрерывно меняет свой состав: она делается более и более темной, выделяет слой смолы на поверхности (который удаляют от времени до времени) и начинает работать хуже, т. е. реакция образования Э. идет неправильно; тогда этерификатор останавливают, опорожняют и наполняют новой смесью; кроме того, приходится добавлять периодически купоросного масла, без остановки хода этерификатора (около 25 пудов в месяц), так как оно разрушается побочными реакциями и уносится с парами Э. механически. Отсюда видно, что реакция образования Э. совершается в условиях более сложных, чем это выражается основным уравнением, и потому не только в смеси этерификатора, но и в самом сыром Э. являются примеси вроде альдегида, винилового спирта, перекиси водорода и др. Из этерификатора пары Э. попадают, как сказано, в нейтрализатор (некоторые заводы не ставят этого прибора) — цилиндр (медный, d = 0,70 м, h = 0,96 м), снабженный тарелками (числом пять), по которым течет раствор щелочи; пары Э., на каждой тарелке, попадают под колпак, зубчатые края которого погружены в жидкость, пройдя которую пары попадают под колпак второй тарелки и т. д. Таким приемом удаляются все примеси кислого характера (расход едкого натра около 0,15 фунта на пуд чистого Э.); важно при этом удалить газообразную SО 2, увлекающую в противном случае пары Э. [По той же причине не следует брать соду вместо едкого натра] Если нейтрализатор отсутствует, то прибавляют извести в ректификатор или в сборный бак в виде известкового молока. Из нейтрализатора пары идут в медный холодильник (при отсутствии нейтрализатора холодильник свинцовый), где и сгущаются в жидкость, стекающую затем в сборный бак. Перед этим последним струя Э. протекает через эпруветку — род фонаря — стеклянный закрытый сосуд с краном, чтобы брать пробы для определения удельного веса, температуры и реакции текущего продукта. В эпруветке же происходит разделение продукта на два слоя: верхний (эфир) и нижний (раствор спирта и Э. в воде), которые и отводятся разными трубами в отдельные баки. Этим и оканчиваются операции по приготовлению сырого Э. Состав полученного продукта обыкновенно следующий: Э. 55 % (по объему), спирта 30 %, воды и других примесей 15 %; в сборном баке он находится в виде двух слоев, из которых верхний есть эфирный раствор спирта, воды и сивушных масел, а нижний — водный раствор солей (натровых), спирта и Э. Такого Э. (сырого) получается от 125 % до 150 % по объему от взятого спирта. Очищение его, т. е. разделение эфира от спирта и примесей, производится дробной перегонкой на аппарате Саваля, составляющей процесс ректификации. Аппарат этот в существенных чертах одинаков с тем, какой употребляется для спирта или бензина (из нефти) и состоит из колонны, дефлегматора и холодильника. Особенность эфирного производства заключается только в том, что комбинируют две колонны: одну для эфира (ректификатор), а другую для остающейся (после отгонки Э.) жидкости, из которой отгоняется спирт (рекуператор); различаются эти колонны только размерами и относительным положением, так как рекуператор ставится ниже ректификатора, чтобы стекающая из последнего (по отгонке Э.) жидкость могла быть самотёком направлена в первый. Выше был указан выход эфира удельного веса 0,723—0,725: один пуд получается из 222° спирта и в лучшем случае из 218° (теоретический выход около пуда из 209°); спирт с рекуператора получается в 92—93°. Остающаяся вода с растворенными солями не утилизируется, а отводится особой трубой. На пуд чистого продукта расходуется 9—10 килограмм пара, что отвечает расходу 1 1/4 пуда каменного угля, считая тут не только расход на нагревание смеси и ректификацию, но и перекачку и электрическое освещение завода.
Контрольные реакции и свойства получаемого Э., должны быть следующие: бесцветность, отсутствие остатка при выпаривании досуха (налёт допускается), нейтральная реакция, удельный вес, указанный выше, отсутствие спирта, альдегида, воды, перекиси водорода, озона [Озону приписывается свойство давать с Э. перекись этила, дающую взрывы; другие опасность взрыва видят в присутствии винилового спирта.] и винилового спирта (CHCHHO) — гомолога аллилового спирта.
Реакция. — 100 куб. см Э. выпаривают на водяной бане до 10 куб. см; прибавляют воды и лакмусового раствора.
Спирт. — В градуированном сосуде взбалтывают 100 куб. см Э. с 50 куб. см воды; объем воды не должен увеличиваться более чем на 5 куб. см (реакция на йодоформ или с уксуснокислым розанилином).
Альдегид — Нейслеровым реактивом или твердым едким кали.
Вода — удаляется амальгамой Al или металлическим Na; открывается встряхиванием с CS 2.
Перекись водорода. — Йодистый калий с крахмалом и несколькими каплями раствора FeSO 4 (синий цвет).
Озон (и перекись водорода). — 1 часть сернокислого бруцина растворяется в 100 частях купоросного масла; к 5 куб. см такого раствора приливается (на поверхность) 1 куб. см Э. — красное окрашивание укажет на озон и H 2O2.
Виниловый спирт. — Смешивают 1 объем насыщенного раствора сулемы и 4,5 объема насыщенного же раствора NаНСО 3, фильтруют и к прозрачному раствору приливают Э. — осадок образуется через 10—15 минут.
К. Н. Егоров. Δ.
|
Page was updated:Tuesday, 11-Sep-2012 18:17:03 MSK |